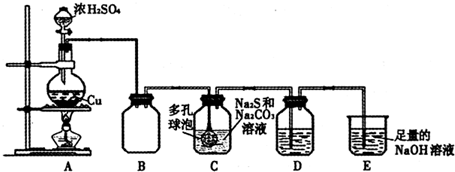
题目内容
10.氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐.从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图1如下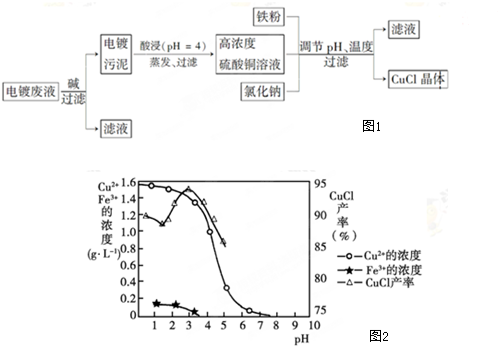
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图2.
【已知:金属离子浓度为1 mol•L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是Cu(OH)2+2H+=Cu2++2H2O;析出CuCl晶体时的最佳pH在3左右.
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为2Cu2++2Cl-+Fe=2CuCl↓+Fe2+.
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h、冷却密封包装.70℃真空干燥、密封包装的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化
(4)产品滤出时所得滤液的主要分成是Na2SO4和FeSO4,若想从滤液中获取FeSO4•7H2O晶体,还需要知道的是不同温度下硫酸钠和硫酸亚铁的溶解度.
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4.为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5.这样做的目的是OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率.
分析 电镀废液中加入碱可生成Cu(OH)2、Fe(OH)3沉淀,在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,最后所得滤液为硫酸亚铁,结合CuCl的性质和题目要求解答该题.
(1)在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,说明氢氧化铜被酸溶解,由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右;
(2)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发;
(4)产品滤出时所得滤液的主要分成是Na2SO4和FeSO4;获取FeSO4•7H2O晶体,还需要知道的是硫酸钠和硫酸亚铁溶解度随温度的变化的情况;
(5)若将铁粉换成亚硫酸钠是亚硫酸钠作为还原剂,失电子,反应方程式为:2 CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2 Na2SO4+H2SO4,加入稀碱溶液消耗氢离子,从平衡正向移动,有利于氯化亚铜的产生,而当氢氧根离子浓度大到一定程度时以达到氢氧化铜的溶度积分析解答.
解答 解:(1)在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,说明氢氧化铜被酸溶解,反应的离子方程式为Cu(OH)2+2H+=Cu2++2H2O,由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,故答案为:Cu(OH)2+2H+=Cu2++2H2O;3;
(2)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化;
(4)产品滤出时所得滤液的主要分成是Na2SO4和FeSO4;获取FeSO4•7H2O晶体,还需要知道的是硫酸钠和硫酸亚铁溶解度随温度的变化的情况,
故答案为:Na2SO4和FeSO4;不同温度下硫酸钠和硫酸亚铁的溶解度;
(5)亚硫酸钠作为还原剂,失电子,发生氧化还原反应,反应方程式为:2 CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2 Na2SO4+H2SO4,加入稀碱溶液消耗氢离子,从平衡正向移动,有利于氯化亚铜的产生,而当氢氧根离子浓度大到一定程度时以达到氢氧化铜的溶度积,所以又析出氢氧化铜,所以调节pH至3.5,
故答案为:2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2 Na2SO4+H2SO4;OH-中和了反应中的H+,有利于平衡向右移动,提高CuCl的产率.但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降低了CuCl的产率.
点评 本题考查制备方案的设计,侧重于学生的分析能力和实验能力的考查,注意把握题给信息,答题时注意审题,把握自学能力的培养,难度中等.

| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2分子中只含σ键,不含π键 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
| A. | 氢 | B. | 钙 | C. | 铁 | D. | 碘 |
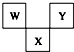 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 | |
| C. | X元素的氧化物、氢化物的水溶液都呈酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
| A. | C2H4 | B. | C4H8 | C. | (CH3)2C=CHCH2CH3 | D. | CH2=CHCH2CH=CH2 |
| A. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | 有机化合物CH3-CH2-NO2和H2N-CH2-COOH是同分异构体 | |
| D. | 加热铝使之熔化克服的是共价键 |