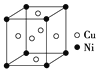
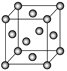
题目内容
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
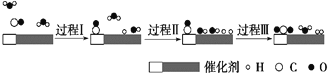
下列说法正确的是( )
A.图示显示:起始时的2个H2O最终都参与了反应
B.过程Ⅰ、过程Ⅱ均为放热过程
C.过程Ⅲ只生成了共价化合物
D.使用催化剂降低了水煤气变换反应的ΔH
【答案】A
【解析】
A. 由图可知过程Ⅰ和过程Ⅱ都存在水分子中的化学键断裂,过程Ⅲ中生成了水分子;
B. 化学键断裂吸收能量,化学键形成放出能量;
C. 过程Ⅲ中生成了H2O、H2和CO2;
D.催化剂能降低反应的活化能。
A. 由图可知过程Ⅰ和过程Ⅱ都存在水分子中的化学键断裂,过程Ⅲ中生成了水分子,因此水参与可反应的所有过程,起始时的2个H2O最终都参与了反应,A项正确;
B. 过程Ⅰ和过程Ⅱ都存在水分子中的化学键断裂,化学键的断裂为吸收热量的过程,B项错误;
C. 过程Ⅲ中生成了H2O、H2和CO2,既有共价化合物,又有共价单质,C项错误;
D.催化剂能降低反应的活化能,不能改变热效应,D项错误;
答案选A。

【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是
A. T2时,CH4的平衡转化率为30.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小