题目内容
【题目】A、B、C、D、E是元素周期表中原子序数依次增大的前四周期元素。A与B同周期,且A元素原子核外s能级有1个未成对电子;B元素的原子核外p电子比s电子少1;C元素的原子序数比B元素多1;D元素的原子价电子有6个未成对电子,它的一种化合物常用于检验酒驾;E元素的原子价电子有4个未成对电子。请回答下列问题:
(1)第一电离能介于A和B之间的同周期元素有___________(填元素符号)。
(2)B元素的最高价氧化物的水化物在水溶液中能完全电离,电离所得阴离子的空间构型为______。写出2种与该阴离子互为等电子体的微粒的化学式:_____。画出基态D原子的价电子排布图:_____。
(3)C元素对应的简单氢化物的沸点明显高于同族其他元素对应的简单氢化物,其原因是___________。
(4)元素D可以形成的配合物如图所示。
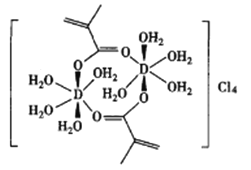
①该配合物中碳原子的杂化类型为___________。
②该配合物中所含化学键的类型不包括___________(填字母)。
a.极性共价键 b.非极性共价键 c.配位键 d.离子键 e.金属键 f.σ键 g.π键
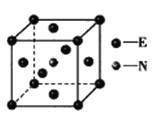
(5)元素E的单质和氮气在640℃可发生置换反应产物之一的晶胞结构如图所示,该反应的化学方程式为___。若该晶体的密度是ρg·cm-3,则两个最近的E原子间的距离为___________cm。(用NA表示阿伏加德罗常数的值)
【答案】Be、B、C、O 平面三角形 C032-、S03 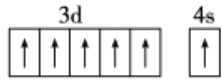 水分子之间存在氢键 sp2、sp3 e 8Fe+2NH3
水分子之间存在氢键 sp2、sp3 e 8Fe+2NH3![]() 2Fe4N+3H2
2Fe4N+3H2 ![]()
【解析】
元素B的核外p电子比s电子少1所以B为N,元素A与元素B同周期,元素A核外s能级有1个未成对电子,所以A为Li,元素C的原子序数比元素B多1,所以C为O,元素D价电子有六个未成对电子,常常用于检验酒驾,所以D为Cr,E元素的原子价电子有4个未成对电子,E为Fe。
(1)A为Li,B为N,第一电离能介于A和B之间的同周期元素有Be、B、C、O,故答案为:Be、B、C、O。
(2)元素N的最高价氧化物的水化物为HNO3,其在水溶液中阴离子为NO3-,价电子对数为3,空间构型为平面三角形;等电子体指价电子数和原子数相同的分子、离子或基团;NO3-等电子体有C032-、S03;基态D原子的价电子排布图为:
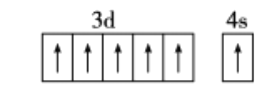 ,故答案为:平面三角形;C032-、S03;
,故答案为:平面三角形;C032-、S03;
 。
。
(3)H2O的沸点明显高于同族其他元素对应的简单氢化物,其原因是水分子之间存在氢键,故答案为:水分子之间存在氢键。
(4)①元素D为Cr,该配合物中碳原子的杂化类型为sp2、sp3,故答案为:sp2、sp3。
②该配合物中所含化学键的类型有极性共价键、非极性共价键、配位键、离子键、σ键 、π键,故不含有金属键,故答案为:e。
(5)根据均摊法:该晶胞中N原子个数是1个,Fe原子个数=8×1/8+6×1/2=4,化学式为Fe4N,铁和氨气在640℃发生置换反应生成氢气和Fe4N,故反应的化学方程式为8Fe+2NH3![]() 2Fe4N+3H2;一个晶胞中Fe原子数目为4个,N原子数目为1,晶胞棱长a=(m/ρ)1/3=[(56×4+14)/ ρNA]1/3,则两个最近的Fe原子间的距离为
2Fe4N+3H2;一个晶胞中Fe原子数目为4个,N原子数目为1,晶胞棱长a=(m/ρ)1/3=[(56×4+14)/ ρNA]1/3,则两个最近的Fe原子间的距离为![]() a=
a=![]() ,故答案为:8Fe+2NH3
,故答案为:8Fe+2NH3![]() 2Fe4N+3H2;
2Fe4N+3H2;![]() 。
。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案