题目内容
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
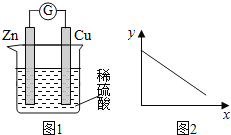
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
【答案】C
【解析】试题分析:铜锌原电池中,Zn是负极,失去电子发生氧化反应,电极反应为Zn-2e-=Zn2+,Cu是正极,氢离子得电子发生还原反应,电极反应为 2H++2e-=H2↑。A.Cu是正极,氢离子得电子发生还原反应,Cu棒的质量不变,故A错误;B.由于Zn是负极,不断发生反应Zn-2e-=Zn2+,所以溶液中c(Zn2+)增大,故B错误;C.由于反应不断消耗H+,所以溶液的c(H+)逐渐降低,故C正确;D.SO42-不参加反应,其浓度不变,故D错误;故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目