题目内容
室温下,pH=a的强酸与pH=b的强碱溶液等体积混合,混合后溶液中H+的物质的量浓度为4.5×10-3mol?L-1(混合前后体积变化不计),已知a+b=13,则a值为( )
| A、1 | B、2 | C、3 | D、4 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:室温下,pH=a的强酸中氢离子浓度为:1×10-amol?L-1,pH=b的强碱溶液中氢氧根离子浓度为:1×10b-14mol?L-1,两溶液等体积混合,混合液中氢离子浓度为4.5×10-3mol?L-1,溶液显示酸性,说明氢离子过量,设两溶液的体积为V,结合a+b=13计算出a.
解答:
解:常温下pH=a的强酸中氢离子浓度为:c(H+)=1×10-amol?L-1,
pH=b的强碱溶液中氢氧根离子浓度为:c(OH-)=1×10b-14mol?L-1,
设两溶液的体积都为VL,则反应后的溶液中:①c(H+)=
=4.5×10-3mol?L-1,
根据a+b=13可得,②b=13-a,
将②带人①解得:a=2,
故选B.
pH=b的强碱溶液中氢氧根离子浓度为:c(OH-)=1×10b-14mol?L-1,
设两溶液的体积都为VL,则反应后的溶液中:①c(H+)=
| (1×10-a-1×10b-14)mol/L×VL |
| 2VL |
根据a+b=13可得,②b=13-a,
将②带人①解得:a=2,
故选B.
点评:本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确溶液中氢离子浓度与溶液pH的关系为解答本题的根据,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列实验操作或现象分析正确的是( )
A、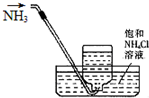 收集氨气 |
B、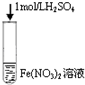 管口出现还原产物NO2红棕色气体 |
C、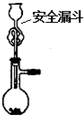 制取二氧化硫 |
D、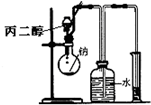 测定丙二醇的分子结构 |
11.2g铁溶解在一定量的某浓度的稀硝酸中,当金属完全反应后生成Fe3+和Fe2+,并收集到标况下3.36L NO气体(设HNO3的还原产物只有NO).则反应中消耗的HNO3的物质的量为( )
| A、0.3mol |
| B、0.45mol |
| C、0.6mol |
| D、0.75mol |
某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( )
| A、电子排布式为1s22s22p63s23p63d34s2 |
| B、该元素为V |
| C、该元素为ⅡA族元素 |
| D、该元素位于d区 |
下列给定条件的各组离子或分子一定能大量共存的是( )
| A、84消毒液:H+、Cl-、K+、SO42- |
| B、透明的KCl溶液:Na+、Cu2+、SO42-、NO3- |
| C、王水中:Ag+、NO3-、Cl-、Au |
| D、空气中:N2、CH4、CO、C6H5OH |
下列电子式或结构式错误的是( )
A、OH-的电子式  |
B、NH4Br的电子式 |
C、CCl4的电子式  |
| D、H2O的结构式H-O-H |
20℃时,饱和KCl溶液的密度为1.174g/cm3,物质的量浓度为4.0mol/L,则下列说法中不正确的是( )
| A、25℃时,饱和KCl溶液的浓度大于4.0mol/L | ||
B、此溶液中KCl的质量分数为74.5×
| ||
| C、20℃时,密度小于1.174g/cm3的KCl溶液是不饱和溶液 | ||
| D、将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g/cm3 |
下列离子方程式书写正确的是( )
| A、Al与冷的浓H2SO4:2Al+12H++3SO42-═2Al3++3SO2+6H2O |
| B、氨水与盐酸反应:H++OH-═H2O |
| C、Fe与FeCl3溶液:Fe+Fe3+═2Fe2+ |
| D、少量Al Cl3溶液滴入NaOH溶液中:Al3++4OH-═「Al(OH)4」- |