题目内容
11.2g铁溶解在一定量的某浓度的稀硝酸中,当金属完全反应后生成Fe3+和Fe2+,并收集到标况下3.36L NO气体(设HNO3的还原产物只有NO).则反应中消耗的HNO3的物质的量为( )
| A、0.3mol |
| B、0.45mol |
| C、0.6mol |
| D、0.75mol |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:n(Fe)=
=0.2mol,根据得失电守恒与硝酸反应生成Fe(NO3)2、Fe(NO3)3和NO,根据N元素守恒计算.
| 11.2g |
| 56g/mol |
解答:
解:根据得失电子守恒2n(Fe2+)+3n(Fe3+)=3n(NO),即:2n(Fe2+)+3n(Fe3+)=3×
,根据铁守恒得:n(Fe2+)+n(Fe3+)=0.2mol,n(Fe3+)=0.05mol,n(Fe2+)=0.15mol,所以消耗的HNO3的物质的量为2n(Fe2+)+3n(Fe3+)+n(NO)=0.45mol+0.15=0.6mol,故选C.
| 3.36L |
| 22.4L/mol |
点评:考查氧化还原反应的计算,难度中等,注意中原子守恒运用,得失电子守恒,否则无法计算,不清楚发生的反应情况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质中,所含化学键类型完全相同的是( )
| A、HCl和MgCl2 |
| B、H2O和CO2 |
| C、Ar和CCl4 |
| D、NH4Cl和NaOH |
21世纪是钛的世纪.在800℃~1000℃时电解TiO2可制得钛,装置如图所示.下列叙述正确的是( )


| A、a为电源的正极 |
| B、石墨电极上发生还原反应 |
| C、阴极发生的反应为:TiO2+4e-═Ti+2O2- |
| D、每生成0.1mol钛,转移电子0.2mol |
下列叙述不正确的是( )
| A、NH3易液化,氨常用作制冷剂 |
| B、NH4Cl中有少量的I2:通过加热的方法除去 |
| C、铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
| D、浓硝酸需保存在棕色瓶中 |
100mL浓度为2mol?L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A、加入适量的6mol?L-1的盐酸 |
| B、加入适量的氯化钠溶液或降温 |
| C、加入适量CH3COOK溶液 |
| D、加入2滴氯化铜溶液或碳粉 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、在水溶液中:H+、I-、NO3-、SiO32- |
| B、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| C、酸性溶液中:H+、NH4+、Al3+、SO42- |
| D、碱性溶液中:NO3-、I-、Na+、Al3+ |
下列实验装置设计正确,且能达到目的是( )
A、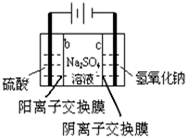 制硫酸和氢氧化钠 |
B、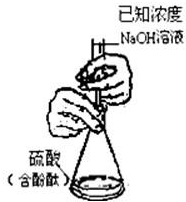 测定硫酸的物质的量浓度 |
C、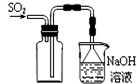 收集SO2 |
D、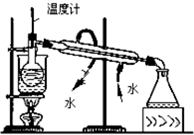 从碘的CCl4溶液中回收CCl4 |
