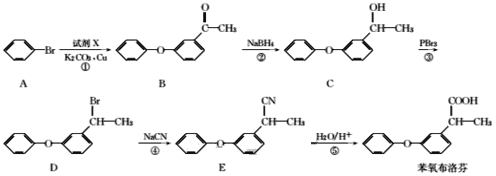
题目内容
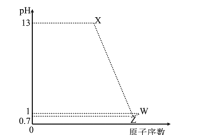
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
(1)实验①反应后的溶液pH=9的原因是___(用离子方程式表示)。
(2)实验①和实验②中水的电离程度较大的是__,该溶液中由水电离出的c(OH-)=__。
(3)x__0.2(填“>”“<”或“=”),若x=a,则室温下HA的电离平衡常数Ka=__(用含a的表达式表示)。
(4)若用已知浓度的KOH滴定未知浓度的一元酸HA,滴定终点的判断方法是__。
【答案】A-+H2O![]() HA+OH- ① 1×10-5mol/l >
HA+OH- ① 1×10-5mol/l > ![]() 当加入最后一滴KOH溶液,锥形瓶中溶液颜色由无色变为浅红色,且半分钟不褪去
当加入最后一滴KOH溶液,锥形瓶中溶液颜色由无色变为浅红色,且半分钟不褪去
【解析】
⑴NaA溶液中,由于A-的水解,使得溶液显碱性。
⑵实验①A-的水解促进水的电离,实验②溶液显中性,水正常电离;该实验中所得溶液中c(H+)=10-9mol/L,计算氢氧根浓度,而溶液中OH-都来自水电离产生。
⑶由于HA显酸性,反应生成的NaA显碱性,要使溶液显中性,则溶液中HA应过量,因此x>0.2 molL1,再根据电离常数计算。
⑷当滴入最后一滴KOH溶液时,锥形瓶内溶液由无色变为浅红色,且半分钟内不褪色。
⑴NaA溶液中,由于A-的水解,使得溶液显碱性,A-水解的离子方程式为:A-+H2OHA+OH-;故答案为:A-+H2OHA+OH-。
⑵实验①A-的水解促进水的电离,实验②溶液显中性,水正常电离,因此实验①中水电离程度较大;该实验中所得溶液的pH=9,溶液中c(H+)=10-9mol/L,则溶液中![]() ,而溶液中OH-都来自水电离产生,因此该溶液中水电离出c(OH-)=1×105molL1;故答案为:①;1×105molL1。
,而溶液中OH-都来自水电离产生,因此该溶液中水电离出c(OH-)=1×105molL1;故答案为:①;1×105molL1。
⑶由于HA显酸性,反应生成的NaA显碱性,要使溶液显中性,则溶液中HA应过量,因此x>0.2 molL1;室温下,HA的电离常数![]() ;故答案为:
;故答案为:![]() 。
。
⑷当反应达到滴定终点时,溶液显碱性,因此滴定终点的现象为:当滴入最后一滴KOH溶液时,锥形瓶内溶液由无色变为浅红色,且半分钟内不褪色;故答案为:当加入最后一滴KOH溶液,锥形瓶中溶液颜色由无色变为浅红色,且半分钟不褪去。