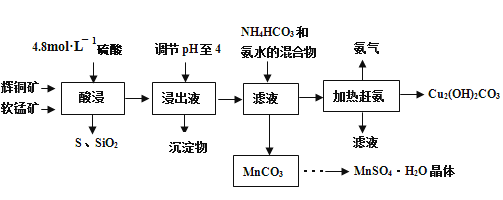
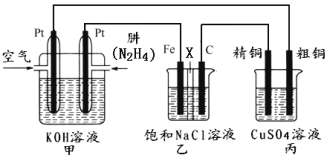
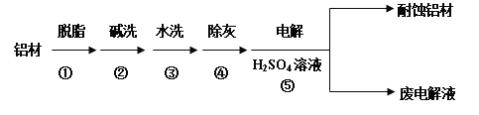
题目内容
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
CO2(g)+H2(g) ΔH<0,在一定温度和压强下于密闭容器中,反应达到平衡时,下列叙述正确的是
A. 升高温度,K增大B. 减小压强,n(CO2)增大
C. 充入一定量的氮气,n(H2)不变D. 更换高效催化剂,CO的转化率增大
【答案】C
【解析】
A.升高温度,平衡向逆反应方向移动;
B.减小压强,平衡向体积增大的方向移动;
C.在一定温度和压强下,充入一定量的氮气,相当于混合气体压强减小,平衡向气体体积增大的方向移动;
D.催化剂不会引起化学平衡的移动。
A.△H<0,说明该反应的正反应是放热反应,升高温度,化学平衡向吸热的逆反应方向移动,化学平衡常数减小,A错误;
B.该反应是反应前后气体体积相等的反应,减小压强,化学平衡不移动,n(CO2)不变,B错误;
C.充入一定量的氮气,相当于混合气体压强减小,但该反应前后气体体积不变,平衡不移动,n(H2)不变,C正确;
D.催化剂能改变反应速率,但不会引起化学平衡的移动,所以CO的转化率不变,D错误;
故合理选项是C。

练习册系列答案
相关题目
【题目】下列图示装置和对应实验原理的描述均正确的是
A | B | C | D |
|
|
|
|
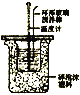
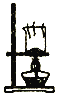
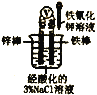
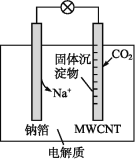
根据温度计读数的变化测定浓硫酸和NaOH溶液反应的反应热 | 加热固体NaHCO3制备少量的Na2CO3 | 验证牺牲阳极的阴极保护法,可证明铁被保护 | 根据小试管中液面的变化可判断铁钉发生了析氢腐蚀 |
A. AB. BC. CD. D