题目内容
【题目】(1)3.6 g H2O的物质的量是____,含有水分子的数目是_____,含有氢原子的物质的量是_____。
(2)1.5molCO2和______g CH4在标准状况下占有相同的体积,其体积为________。
(3)在标准状况下,100mL某气体的质量为0.179g,该气体的相对分子质量为________。
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为______mol;一个X原子的质量为_______g;该气体在标准状况下的体积为______L。
【答案】0.2 mol 0.2×6.02×1023 0.4mol 24 33.6 L 40.096 m/M ![]() 22.4m/M
22.4m/M
【解析】
(1)3.6 g H2O的物质的量是3.6g/18g·mol-1=0.2mol,含有水分子的数目是0.2mol×6.02×1023mol-1=0.2×6.02×1023,含有氢原子的物质的量是0.2mol×2=0.4mol。故答案为:0.2 mol,0.2×6.02×1023,0.4mol。
(2)1.5molCO2在标准状况下的体积为1.5mol×22.4L/mol=33.6L,在同温同压下,CO2和CH4所占体积相同,则CO2和CH4物质的量相同,所以CH4的物质的量也为1.5mol,1.5moLCH4的质量为1.5mol×16g/mol=24g。故答案为24,33.6 L。
(3)在标准状况下,100mL气体的物质的量为0.1L÷22.4L·mol-1=1/224mol。质量为0.179g的该气体的相对分子质量为0.179÷1/224=40.096。
(4)mgX2气体的物质的量为m/Mmol,1mol X2的质量为M g,则一个X2分子的质量为![]() g,那么一个X原子的质量为
g,那么一个X原子的质量为![]() g,该气体在标准状况下的体积为m/Mmol×22.4L/mol=22.4m/M L。故答案为:m/M,
g,该气体在标准状况下的体积为m/Mmol×22.4L/mol=22.4m/M L。故答案为:m/M,![]() ,22.4m/M。
,22.4m/M。

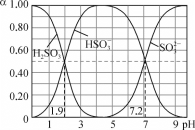
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 |
|
|
|
|
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A. 酸性强弱: ![]()
B. 离子的总浓度:①>③
C. ②中: ![]()
D. ②和④中![]() 相等
相等
【题目】如图为实验室利用少量Cu片和过量浓硝酸制取NO2气体的装置。
(1)烧瓶中产生气体的颜色是_________;
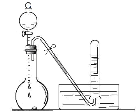
(2)反应结束后,将烧瓶浸入冰水中,发生反应2NO2(g)![]() N2O4(g)ΔH=-53kJ/mol。此时烧瓶内气体颜色______(填“变深”、“不变”或“变浅”),使用相关化学用语和必要的文字说明颜色变化的原因__________________________________。
N2O4(g)ΔH=-53kJ/mol。此时烧瓶内气体颜色______(填“变深”、“不变”或“变浅”),使用相关化学用语和必要的文字说明颜色变化的原因__________________________________。
(3)在80℃时,将0.40molN2O4气体充入2L已经抽成真空的固定容积的密闭容器I中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算a=_________,此温度时该反应(N2O4作为反应物)的平衡常数K=_________。
反应达平衡时,共吸收热量________kJ。
②在其他条件不变时,改变条件,使反应再次达到平衡,能使c(NO2)/c(N2O4)比值变小的措施有(填字母)________。
A.降低温度 B.使用高效催化剂
C.升高温度 D.通入稀有气体,使容器内压强增大