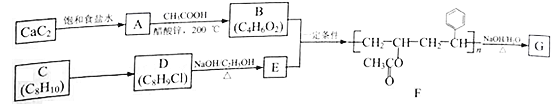
题目内容
【题目】纳米级Co3O4是一种电极材料,可用草酸盐湿式沉淀—煅烧分解法制备。
(1)先用(NH4)2C2O4溶液和CoCl2溶液为原料制取难溶于水的CoC2O4·2H2O晶体。
①已知25 ℃,Kb(NH3·H2O)=1.8×10-5,H2C2O4的Ka1=5.6×10-2,Ka2=5.4×10-5。(NH4)2C2O4溶液的pH__ (填“>”“=”或“<”)7。
②反应时,使(NH4)2C2O4过量的原因是________________________。
(2) 为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575 g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385 ℃以上残留固体均为金属氧化物)

①B处的物质为________(填化学式)。
②经测定,205~385 ℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积。(写出计算过程,结果保留2位有效数字) ________。
【答案】< 使Co2+充分沉淀(或提高Co2+的沉淀率) Co3O4 n(CoC2O4·2H2O)=4.575 g/183 gmol-1=0.025 mol
CoC2O4·2H2O中m(H2O)=0.025 mol×2×18 g·mol-1=0.9 g
CoC2O4·2H2O中m(CoC2O4)=4.575 g-0.9 g=3.675 g
根据图中A点数据可知,A为CoC2O4
AB段发生反应的化学方程式为3CoC2O4+2O2===Co3O4+6CO2
V(O2)=2/3×0.025 mol×22.4 L·mol-1=0.37 L (其他合理计算步骤也给分)
【解析】
(1) ①电解质越弱,相应的离子水解程度越大;
②为制备难溶于水的CoC2O4·2H2O晶体,反应更充分,可使(NH4)2C2O4过量;
(2)①根据钴元素守恒计算产物成分。;
②结合元素守恒法推出A的剩余固体的成分,再根据实际反应的化学方程式的计量数分析作答。
(1) ①(NH4)2C2O4溶液中,铵根离子水解显酸性,C2O42-以第一步水解为主,其水解方程式为:C2O42- +H2O![]() HC2O4-+OH-,其水溶液显碱性,又Kb(NH3·H2O)=1.8×10-5,H2C2O4的Ka2=5.4×10-5,弱电解质的电离平衡常数越小,盐溶液水解程度越大,则铵根离子的水解程度大于草酸根离子的水解程度,使(NH4)2C2O4溶液显酸性,即pH < 7,
HC2O4-+OH-,其水溶液显碱性,又Kb(NH3·H2O)=1.8×10-5,H2C2O4的Ka2=5.4×10-5,弱电解质的电离平衡常数越小,盐溶液水解程度越大,则铵根离子的水解程度大于草酸根离子的水解程度,使(NH4)2C2O4溶液显酸性,即pH < 7,
故答案为:<;
②反应时,使(NH4)2C2O4过量,可使Co2+充分沉淀,提高Co2+的沉淀率,
故答案为:使Co2+充分沉淀(或提高Co2+的沉淀率);
(2)①4.575 g的CoC2O4·2H2O中Co原子的物质的量 = ![]() = 0.025 mol,若获得的产物为Co3O4,则其质量应为
= 0.025 mol,若获得的产物为Co3O4,则其质量应为![]() ×0.025 mol×241 g/mol = 2.008 g,根据图示信息可知,B处的物质为Co3O4,
×0.025 mol×241 g/mol = 2.008 g,根据图示信息可知,B处的物质为Co3O4,
故答案为:Co3O4;
②因CoC2O4·2H2O 的质量为4.575 g,则n(CoC2O4·2H2O)=4.575 g/183 gmol-1=0.025 mol
而CoC2O4·2H2O中结晶水的质量为m(H2O)=0.025 mol×2×18 g·mol-1=0.9 g,
可得CoC2O4·2H2O中CoC2O4的质量m(CoC2O4)=4.575 g-0.9 g=3.675 g
根据图中A点数据可知,A的成分为CoC2O4
故AB段发生反应的化学方程式为3CoC2O4+2O2===Co3O4+6CO2
再标准状况下,所得氧气的体积V(O2)=![]() ×0.025 mol×22.4 L·mol-1=0.37 L
×0.025 mol×22.4 L·mol-1=0.37 L
答案为:n(CoC2O4·2H2O)=4.575 g/183 gmol-1=0.025 mol
CoC2O4·2H2O中m(H2O)=0.025 mol×2×18 g·mol-1=0.9 g
CoC2O4·2H2O中m(CoC2O4)=4.575 g-0.9 g=3.675 g
根据图中A点数据可知,A为CoC2O4
AB段发生反应的化学方程式为3CoC2O4+2O2===Co3O4+6CO2
V(O2)=2/3×0.025 mol×22.4 L·mol-

 阅读快车系列答案
阅读快车系列答案【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g) + O2(g) ![]() 2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 前5 min的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和0.2 mol SO3(g)时,υ正> υ逆
C. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为40%
D. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ 的热量