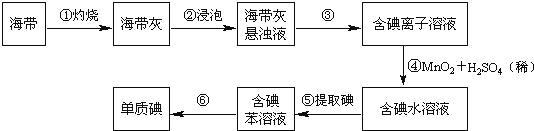
题目内容
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:2NO(g) + O2(g) ![]() 2NO2(g) △H= -113.0 kJ·mol-1,2SO2(g)+ O2 (g)
2NO2(g) △H= -113.0 kJ·mol-1,2SO2(g)+ O2 (g) ![]() 2SO3(g) △H=-196.6 kJ·mol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
2SO3(g) △H=-196.6 kJ·mol-1,SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为__________________________。
② 随温度升高,该反应化学平衡常数变化趋势是____________。(填“增大”或“减小”或“不变”)
(2)提高2SO2 + O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该温度下反应的平衡常数K=_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,升高体系温度
(3)汽车尾气是氮氧化物的一个主要来源。汽缸中生成NO的反应为:N2 (g) + O2 (g) ![]() 2NO(g) △H>0
2NO(g) △H>0
汽车启动后,汽缸温度越高,单位时间内NO的排放量越大,其原因是_______________。
(4)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式____________________。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
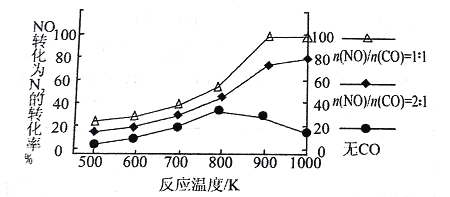
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别 为________、________;该反应的H________0(填“>”、“<”或“=”)。
【答案】NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1 减小 2L/mol bc 升高温度,反应速率加快,平衡向正向移动,则NO的排放量单位时间内增多 2NO+2CO![]() N2+2CO2 900K n(NO)/n(CO)=1∶1 >
N2+2CO2 900K n(NO)/n(CO)=1∶1 >
【解析】
根据盖斯定律计算反应热;根据化学平衡常数的计算公式及其与温度的关系、外因对化学平衡的影响进行相关的判断;认真分析图象中信息。
(1)给已知热化学方程式编号:
(a)2NO(g) + O2(g) ![]() 2NO2(g) △H= -113.0 kJ·mol-1,
2NO2(g) △H= -113.0 kJ·mol-1,
(b)2SO2(g)+ O2 (g) ![]() 2SO3(g) △H=-196.6 kJ·mol-1 。
2SO3(g) △H=-196.6 kJ·mol-1 。
①消去无关物质O2,将(b-a)/2得NO2和SO2反应的热化学方程式:
NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1 。
②温度升高,平衡左移,该反应化学平衡常数减小。
(2)①温度T、1L:2SO2 + O2 ![]() 2SO3
2SO3
起始/mol 2.0 1.0 0
转化/mol 2.0×50% 0.5 1.0
平衡/mol 1.0 0.5 1.0
平衡时SO2、O2、SO3浓度分别是1.0mol·L-1、0.5mol·L-1、1.0mol·L-1, T温度时反应的平衡常数K=2L/mol。
②a.温度和容器体积不变时充入He,化学平衡不移动,SO2的转化率不变;b.温度和容器体积不变时充入1.0 mol O2,平衡右移,SO2的转化率增大;c.在其他条件不变时减少容器的体积,即增大压强,平衡右移,SO2的转化率增大;d.在其他条件不变时升高体系温度,平衡左移,SO2的转化率减小。选bc。
(3)对于反应:N2 (g) + O2 (g) ![]() 2NO(g) △H>0,升高温度,反应速率加快,平衡向正向移动,则单位时间内NO的排放量增多。
2NO(g) △H>0,升高温度,反应速率加快,平衡向正向移动,则单位时间内NO的排放量增多。
(4)①CO还原NO生成N2的化学方程式2NO+2CO![]() N2+2CO2。
N2+2CO2。
②从图中看,900K、n(NO)/n(CO)=1∶1时,NO转化为N2的转化率最大。当n(NO)/n(CO)一定时,温度升高,NO转化率增大。故正反应吸热、H>0。