题目内容
【题目】按要求填空。
(1)在下列化学方程式中,双线桥法标出电子转移并填空。3S+6KOH![]() K2SO3+2K2S+3H2O___,氧化剂___,还原剂___;2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑___,氧化剂___,被氧化的物质_____;3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O___,被还原的物质_____,还原剂______。
K2SO3+2K2S+3H2O___,氧化剂___,还原剂___;2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑___,氧化剂___,被氧化的物质_____;3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O___,被还原的物质_____,还原剂______。
(2)请把符合要求的化学反应方程式的编号填入括号内:是分解反应又是氧化还原反应的是___,是分解反应不是氧化还原反应的是___,是化合反应又是氧化还原反应的是___,是化合反应不是氧化还原反应的是___,不属于四种基本反应类型的氧化还原反应的是___。
A.2KClO3![]() 2KCl+3O2↑ B.2Fe+3Cl2
2KCl+3O2↑ B.2Fe+3Cl2![]() 2FeCl3 C.NH4HCO3
2FeCl3 C.NH4HCO3![]() NH3↑+H2O+CO2↑D.CaO+CO2=CaCO3 E.Cl2+H2O=HCl+HClO
NH3↑+H2O+CO2↑D.CaO+CO2=CaCO3 E.Cl2+H2O=HCl+HClO
【答案】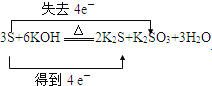 S S
S S 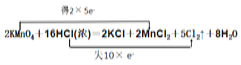 KMnO4 HCl
KMnO4 HCl  HNO3 Cu A C B D E
HNO3 Cu A C B D E
【解析】
(1)结合氧化还原反应的概念用双线桥分析,在氧化还原反应中的,化合价升高值=化合价降低值=转移电子数目;
(2)化合价发生改变的反应一定是氧化还原反应,置换反应的化合价一定发生了改变,一定属于氧化还原反应,复分解反应前后元素化合价一定不变,一定不属于氧化还原反应结合四大基本反应类型的概念来回答。
(1)在3S+6KOH![]() K2SO3+2K2S+3H2O中S元素的化合价既升高又降低,则S既是氧化剂,又是还原剂,用双线桥分析电子转移的方向及数目为
K2SO3+2K2S+3H2O中S元素的化合价既升高又降低,则S既是氧化剂,又是还原剂,用双线桥分析电子转移的方向及数目为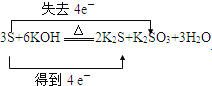 ;KMnO4和浓盐酸发生反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,KMnO4中锰元素化合价降低被还原,为氧化剂,HCl中Cl元素化合价升高被氧化,则被氧化的物质是HCl,用双线桥分析电子转移的方向及数目为
;KMnO4和浓盐酸发生反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,KMnO4中锰元素化合价降低被还原,为氧化剂,HCl中Cl元素化合价升高被氧化,则被氧化的物质是HCl,用双线桥分析电子转移的方向及数目为 ;在3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O中,N元素化合价降低,Cu元素化合价升高,则被还原的物质为HNO3,还原剂为Cu,用双线桥分析电子转移的方向及数目为
;在3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O中,N元素化合价降低,Cu元素化合价升高,则被还原的物质为HNO3,还原剂为Cu,用双线桥分析电子转移的方向及数目为 。
。
(2)A.2KClO3![]() 2KCl+3O2↑反应物有一种,生成物有多种属于分解反应,存在化合价的变化,属于氧化还原反应;
2KCl+3O2↑反应物有一种,生成物有多种属于分解反应,存在化合价的变化,属于氧化还原反应;
B.2Fe+3Cl2![]() 2FeCl3的反应物两种,生成物只有一种,属于化合反应,该反应中存在化合价的变化,属于氧化还原反应;
2FeCl3的反应物两种,生成物只有一种,属于化合反应,该反应中存在化合价的变化,属于氧化还原反应;
C.NH4HCO3﹦NH3↑+H2O+CO2↑反应物有一种,生成物有多种属于分解反应,不存在化合价的变化,不属于氧化还原反应;
D.反应CaO+CO2=CaCO3的反应物两种,生成物只有一种,属于化合反应,该反应不存在化合价的变化,不属于氧化还原反应;
E.Cl2+H2O﹦HCl+HClO中存在元素化合价的变化,是氧化还原反应,不属于四大基本反应类型;
则:是分解反应又是氧化还原反应的是A,是分解反应不是氧化还原反应的是C,是化合反应又是氧化还原反应的是B,是化合反应不是氧化还原反应的是D,不属于四种基本反应类型的氧化还原反应的是E。

【题目】实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验。请完成下列填空:
(1)配制500mL 0.1000mol·L-1 NaOH 标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、__________、__________等。
②称取__________g氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、__________
(2)取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用__________(填仪器名称)盛装配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
滴定次数 | 待测盐酸 的体积/mL | 标准NaOH溶液体积 | |
滴定前的刻度/mL | 滴定后的刻度/rnL | ||
第一次 | 20.00 | 0.40 | 20.50 |
第二次 | 20.00 | 4.10 | 24.00 |
第三次 | 20.00 | 1.00 | 24.00 |
(3)①如何判断滴定终点:____________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________mol·L-1。
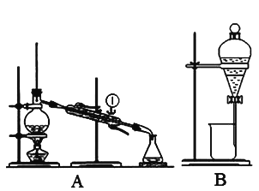
③排去碱式滴定管中气泡的方法应采用下图操作中的__________(填序号),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定果偏低的有__________(填序号)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有Na2CO3固体
D.滴定终点读数时俯视读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失