题目内容
【题目】(一)Na、Cu、O、Si、S、Cl是常见的六种元素.
(1)Na位于元素周期表第__周期第__族;S的基态原子核外有__个未成对电子;
Si的基态原子核外电子排布式为__.
(2)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
Si______S | O2-______Na+ | NaCl ______ Si | H2SO4 __________HClO4 |
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取.写出该反应的离子方程式,并标出电子转移的方向和数目___
(二).某元素的原子序数为33,请回答:
(1)该元素原子核外有_______个电子层,______个能级,______个原子轨道。
(2)它的最外层电子排布式为____________,它的电子排布式为________,轨道表示式为_______________。
【答案】三 IA 2 1s22s22p63s23p2 < > < < ![]() 4 8 18 4s24p3 1s22s22p63s23p63d104s24p3
4 8 18 4s24p3 1s22s22p63s23p63d104s24p3 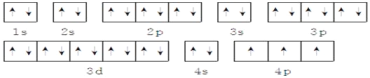
【解析】
(一)、
(1)Na元素位于元素周期表第三周期第IA族;S的基态原子核外未成对电子处于3p轨道,共2个未成对电子;Si原子核外电子数为14,核外电子基态排布式为1s22s22p63s23p2,
故答案为:三;IA;2;1s22s22p63s23p2。
(2)同一周期元素,随着原子序数的增加,原子核对核外电子的吸引力增强,第一电离能增大,增大而增大,所以第一电离能:S>Si;核外电子排布相同的离子,核电荷数越大,离子半径越小,所以离子半径:O2->Na+;一般来说,原子晶体(Si)的熔点高于离子晶体(NaCl)的熔点,故熔点:Si>NaCl;元素的非金属性越强,元素最高价氧化物的水化物的酸性越强,因为非金属性Cl>S,所以酸性:HClO4>H2SO4;
故答案为:<;>;<;<。
(3)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子方程式、电子转移的方向和数目表示为![]() ,
,
故答案为:![]() 。
。
(二)、
(1)根据核外电子排布规律写出33号元素的核外电子排布式:1s22s22p63s23p63d104s24p3,所以该元素原子核外有4个电子层,有8个能级,该元素原子中被电子占据的轨道,s轨道有4个,p轨道有3×3=9个,d轨道有5个,所以占据的原子轨道总共有18个,故答案为:4;8;18。
(2)该元素的核外电子排布式:1s22s22p63s23p63d104s24p3,最外层电子排布式为4s24p3,轨道表示式为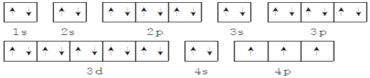 ,故答案为:4s24p3; 1s22s22p63s23p63d104s24p3;
,故答案为:4s24p3; 1s22s22p63s23p63d104s24p3; 。
。

【题目】A、B、C、D, E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第_______周期_______族;B元素和C元素的第一电离能比较,较大的是________,C元素和F元素的电负性比较,较小的是________。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子模型为________,B元素所形成的单质分子![]() 键与π键数目之比为________。
键与π键数目之比为________。
(3)G元素的低价阳离子的离子结构示意图是________,F元素原子的价电子的轨道表示式是________,H元素的基态原子核外电子排布式的________。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为_________________;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的离子方程式:_________________。