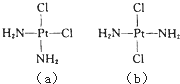题目内容
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),
下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池工作时,电子由负极通过外电路流向正极
C. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
D. 外电路中每通过0.4mol电子,锌的质量理论上减小6.5g
【答案】D
【解析】A,原电池工作原理是:负极失电子,发生氧化反应,根据总反应可知失电子的是金属锌,故正确;B,电池工作时,电子由负极流向正极,故正确;C,正极得电子,发生还原反应,所以正极的电极反应式为: ![]() ,故C正确;
,故C正确;
D,根据电池反应![]() ,消耗1mo的金属锌,转移电子2mol是,所以当外电路中每通过01mol电子,消0.05mol金属锌,锌的质量理论上减小
,消耗1mo的金属锌,转移电子2mol是,所以当外电路中每通过01mol电子,消0.05mol金属锌,锌的质量理论上减小![]() ,故错误.本题答案:D。
,故错误.本题答案:D。

【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
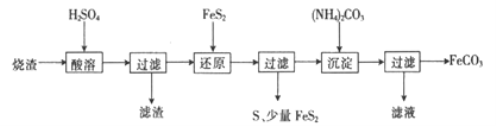
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________