题目内容
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( ) 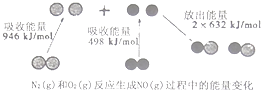
A.1molN2(g)和1molO2(g)反应放出的能量为180kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
【答案】B
【解析】解:A、焓变=反应物断裂化学键吸收的能量﹣生成物形成化学键放出的能量,N2+O2=2NO,△H=946KJ/mol+498KJ/mol﹣2×632KJ/mol=180KJ/mol,反应是吸热反应,故A错误; B、依据A计算可知反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故B正确;
C、通常情况下,N2(g)和O2(g)混合不能直接生成NO,故C错误;
D、一氧化氮不能和氢氧化钠反应,不是酸性氧化物,故D错误;
故选B.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目