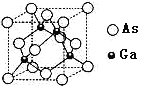
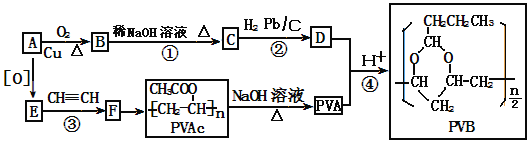
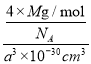题目内容
【题目】下列水解反应离子方程式书写正确的是( )
A.CH3COOH+OH﹣CH3COO﹣+H2O
B.S2﹣+2H2OH2S+2OH﹣
C.CH3COOH+H2OCH3COO﹣+H3O+
D.CO32﹣+H2OHCO3﹣+OH﹣
【答案】D
【解析】解:A.CH3COOH+OH﹣CH3COO﹣+H2O是酸与氢氧根离子的反应,属于酸碱中和反应的离子方程式,故A错误;
B.硫离子的水解方程式为:S2﹣+H2OHS﹣+OH﹣,故B错误;
C.CH3COOH+H2OCH3COO﹣+H3O+是醋酸的电离方程式,不是水解方程式,故C错误;
D.CO32﹣的水解离子方程式为CO32﹣+H2OHCO3﹣+OH﹣,故D正确.
故选D.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
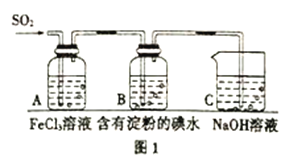
周周清检测系列答案【题目】火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: .
(2)工业上用Na2SO3溶液吸收烟气中的SO2 . 将烟气通入1.0molL﹣1的Na2SO3溶液,溶液pH不断减小.当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂. ①此时溶液中c(SO32﹣)的浓度是0.2molL﹣1 , 则溶液中c(HSO3﹣)是molL﹣1 .
②向pH约为6的吸收剂中通入足量的O2 , 可将其中的NaHSO3转化为两种物质,反应的化学方程式是 .
③某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示.则: , 有利于提高SO2的吸收效率.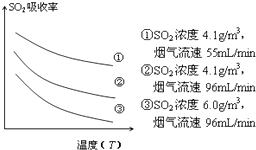
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下: 步骤i称取样品1.000g.
步骤ii将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤iii移取25.00mL样品溶液于250mL锥形瓶中,用0.01000molL﹣1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
①写出步骤iii所发生反应的离子方程式;
②在配制0.01000molL﹣1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量(填“偏大”、“偏小”或“无影响”).
③某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是(填字母).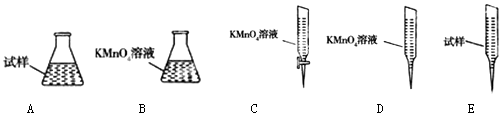
④滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 2.20 | 20.20 |
则该药品中Na2SO3的质量分数为 .