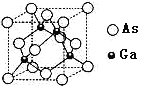
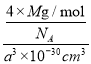题目内容
【题目】常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO ![]() )>c(CO
)>c(CO ![]() )>c(H2CO3)
)>c(H2CO3)
C.0.2mol?L﹣1 CH3COOH溶液与0.1mol?L﹣1 NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH)
D.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
【答案】C
【解析】解:A.溶液中存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣),所以c(Na+)<c(Cl﹣)+c(ClO﹣)+c(OH﹣),故A错误;B.pH=8.3的NaHCO3溶液中,碳酸氢根离子水解程度大于电离程度,则c(CO ![]() )<c(H2CO3),故B错误;
)<c(H2CO3),故B错误;
C.二者混合时,溶液中的溶质是等物质的量浓度的CH3COOH和CH3COONa,依据溶液中物料守恒得2c(Na+)=c(CH3COOH)+c(CH3COO﹣),根据电荷守恒得c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),所以得2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH),故C正确;
D.pH=11的氨水与pH=3的盐酸等体积混合,氨水过量导致溶液呈碱性,则c(OH﹣)>c(H+),根据电荷守恒得c(Cl﹣)<c(NH ![]() ),故D错误;
),故D错误;
故选C.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
【答案】C
【解析】①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,说明溶液中含有0.02mol NH4+,同时产生红褐色沉淀为氢氧化铁,说明溶液中含有Fe3+,CO32-与Fe3+会发生双水解而不能大量共存,故溶液中一定不含CO32-;②将沉淀过滤、洗涤、灼烧,得到1.6 g固体为氧化铁,则n[Fe(OH)3]=2n(Fe2O3)=2×![]() =0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)=
=0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)= ![]() =0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
=0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
【题型】单选题
【结束】
8
【题目】根据要求回答下列问题:
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列图像说明该反应进行到t1时刻未达平衡状态的是________(填选项字母)。
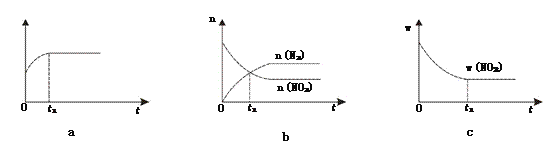
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。
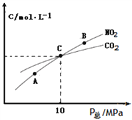
图中A、B、C三点NO2的转化率最高的是_____,该反应的平衡常数Kp=_______(Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
物质 | H2CO | H2S | HNO2 |
电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
②25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
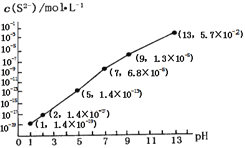
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
则:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.