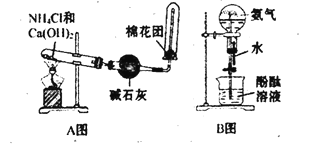
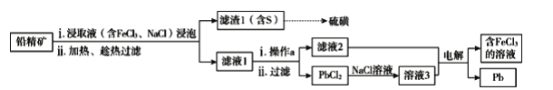
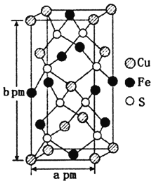
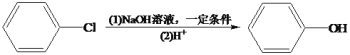题目内容
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由其中两种上述元素组成的化合物,它们存在转化关系Q![]() P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是( )
A.原子半径:Y>Z>W>X
B.简单气态氢化物的热稳定性:Z>Y
C.物质M具有漂白性
D.Q既能与强酸溶液反应,又能与强碱溶液反应
【答案】A
【解析】
P能使湿润的红色石蕊试纸变蓝,则P为氨气,N常温常压下为液体,主族元素形成的化合物,常温常压下为液体的常见的是H2O,则已确定三种元素:H、N、O,M为同族元素形成的化合物,则为SO2,则Q为亚硫酸氢铵或亚硫酸铵,受热分解生成NH3、SO2、H2O。
由分析可知,P为NH3,M为SO2,N为H2O,X、Y、Z、W分别为H、N、O、S。
A.同一周期从左向右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径:S>N>O>H,故A错误;
B.非金属性:O>N,则简单气态氢化物的热稳定性:H2O>NH3,故B正确;
C.M为SO2,具有漂白性,故C正确;
D.Q可能为亚硫酸铵或亚硫酸氢铵,既能与强酸溶液反应,又能与强碱溶液反应,故D正确;
故答案为A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目