题目内容
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:
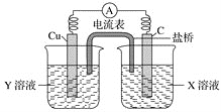
①写出电极反应式:
正极___________;负极__________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”、“阴”)离子向X溶液方向移动。
(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。
2Fe2++I2设计成如图所示的原电池。
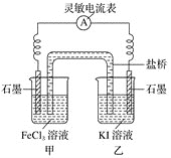
请回答下列问题:
①反应开始时,乙中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为________。甲中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为______。
②电流表读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作________(填“正”或“负”)极,该电极的电极反应式为________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为________。
【答案】2Fe3++2e-=2Fe2+ Cu-2e-=Cu2+ FeCl3 CuCl2 阳 氧化 2I--2e-=I2 还原 2Fe3++2e-=2Fe2+ 正 I2+2e-=2I- O2+4e-+4H+=2H2O
【解析】
(1)①原电池中正极得到电子,则根据方程式可知正极是铁离子得到电子,正极电极反应式为2Fe3++2e-=2Fe2+,负极是铜失去电子,电极反应式为Cu-2e-=Cu2+;
②图中碳棒是正极,铜棒是负极,因此X溶液是FeCl3,Y溶液是CuCl2;
③原电池工作时溶液中的阳离子向正极移动,因此盐桥中的阳离子向X溶液方向移动。
(2)①碘离子失去电子,则乙中石墨是负极,所以反应开始时,乙中石墨电极上发生氧化反应,电极反应式为2I--2e-=I2。甲中石墨电极上发生还原反应,电极反应式为2Fe3++2e-=2Fe2+;
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,平衡向逆反应方向进行,则乙中的石墨正极,该电极的电极反应式为I2+2e-=2I-;
(3)根据方程式可知氧气得到电子,所以氧气在正极放电,溶液显酸性,则电极反应式为O2+4e-+4H+=2H2O。
(1)①原电池中正极得到电子,电极反应式为2Fe3++2e-=2Fe2+,故答案为2Fe3++2e-=2Fe2+,负极是铜失去电子,电极反应式为Cu-2e-=Cu2+,故答案为Cu-2e-=Cu2+;
②碳棒是正极,铜棒是负极,因此X溶液是FeCl3,Y溶液是CuCl2,故答案为FeCl3, CuCl2;
③原电池工作时溶液中的阳离子向正极移动,因此盐桥中的阳离子向X溶液方向移动,故答案为阳。
(2)①碘离子失去电子,则乙中石墨是负极,所以反应开始时,乙中石墨电极上发生氧化反应,电极反应式为2I--2e-=I2。甲中石墨电极上发生还原反应,电极反应式为2Fe3++2e-=2Fe2+,故答案为氧化,2I--2e-=I2,还原,2Fe3++2e-=2Fe2+;
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,平衡向逆反应方向进行,则乙中的石墨正极,该电极的电极反应式为I2+2e-=2I-,故答案为正, I2+2e-=2I-;
(3)氧气得到电子,所以氧气在正极放电,溶液显酸性,则电极反应式为O2+4e-+4H+=2H2O,故答案为O2+4e-+4H+=2H2O。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】下列有关反应热的叙述中正确的是 ( )
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ· mol-1,则氢气的燃烧热ΔH=-241.8 kJ· mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:下表数据可以计算出![]() (g)+3H2(g)
(g)+3H2(g)![]()
![]() (g)的焓变
(g)的焓变
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
⑤根据盖斯定律可推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2(g)时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2(g)所放出的热量为碳的燃烧热
A.①②③④B.③④⑤C.④⑤D.⑥
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
