题目内容
【题目】硫酸亚铁(![]() )是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
)是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
实验室通过图7装置模拟其制备过程。请回答下列问题:
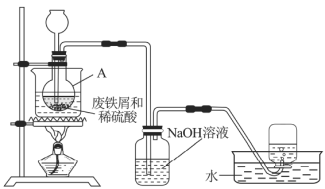
(1)进行实验之前需检查整套装置的______。装置甲中仪器A的名称是______,铁和稀硫酸反应后所得溶液呈______色。
(2)常温下废铁屑和稀硫酸反应较慢,而直接加热时温度过高又可能产生![]() 等副产物,因此,采用水浴加热,并使用过量的
等副产物,因此,采用水浴加热,并使用过量的![]() 将可能产生的
将可能产生的![]() 还原成
还原成![]() 。
。![]() 还原
还原![]() 的离子方程式为______________。
的离子方程式为______________。
(3)为验证反应后A中溶液是否含![]() ,取A中少量溶液快速冷却后,迅速滴入几滴
,取A中少量溶液快速冷却后,迅速滴入几滴![]() 溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)
溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)![]() 。
。
(4)废铁屑中含有硫化物杂质,故反应中会生成少量的![]() 气体。因此,装置乙中
气体。因此,装置乙中![]() 溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
(5)将![]() 废铁屑(
废铁屑(![]() 单质的质量分数为80%,杂质为
单质的质量分数为80%,杂质为![]() 和
和![]() )与
)与![]() 的
的![]() 溶液充分反应,
溶液充分反应,![]() 的理论产量为____
的理论产量为____![]()
【答案】气密性 长颈漏斗 浅绿 Fe + 2Fe3+=3Fe2+ 不含 吸收H2S 氢气 9.12
【解析】
根据实验原理及实验装置分析相关反应及实验现象;根据物质性质及常见离子的检验方法分析解答;
(1)该实验中有氢气生成,所以进行实验之前需检查整套装置的气密性;根据图示仪器构造分析,装置甲中仪器A的名称是长颈漏斗;铁和稀硫酸反应生成硫酸亚铁和氢气,所得溶液呈浅绿色,故答案为:气密性;长颈漏斗;浅绿;
(2)![]() 还原
还原![]() 生成Fe2+,离子方程式为Fe + 2Fe3+=3Fe2+,故答案为:Fe + 2Fe3+=3Fe2+;
生成Fe2+,离子方程式为Fe + 2Fe3+=3Fe2+,故答案为:Fe + 2Fe3+=3Fe2+;
(3)Fe3+结合SCN-会生成红色物质,溶液颜色无明显变化,说明A中溶液不含![]() ,故答案为:不含;
,故答案为:不含;
(4)![]() 气体呈酸性,装置乙中
气体呈酸性,装置乙中![]() 溶液的主要作用是吸收H2S,装置丙中集气瓶收集到的气体主要是反应生成的氢气,故答案为:吸收H2S,氢气;
溶液的主要作用是吸收H2S,装置丙中集气瓶收集到的气体主要是反应生成的氢气,故答案为:吸收H2S,氢气;
(5)废铁屑中单质铁的物质的量为n(Fe)=![]() ,n(H2SO4)=0.02L×3.0mol/L=0.06mol,根据反应Fe+H2SO4=FeSO4+H2↑得,硫酸不足,则m(FeSO4)=152g/mol×0.06mol=9.12g,故答案为:9.12。
,n(H2SO4)=0.02L×3.0mol/L=0.06mol,根据反应Fe+H2SO4=FeSO4+H2↑得,硫酸不足,则m(FeSO4)=152g/mol×0.06mol=9.12g,故答案为:9.12。

【题目】下列有关反应热的叙述中正确的是 ( )
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ· mol-1,则氢气的燃烧热ΔH=-241.8 kJ· mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:下表数据可以计算出![]() (g)+3H2(g)
(g)+3H2(g)![]()
![]() (g)的焓变
(g)的焓变
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
⑤根据盖斯定律可推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2(g)时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2(g)所放出的热量为碳的燃烧热
A.①②③④B.③④⑤C.④⑤D.⑥
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大