��Ŀ����
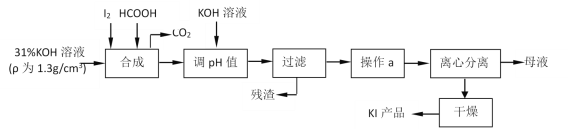
����Ŀ���������Ϊʳ���������Ӽ������⻯�����ǻ���������һ����Ҫԭ�ϡ���ԭ�������⻯�����ɵ����������ط�Ӧ���ɵ���غ��ü��ỹԭ���ã�����Ҫ������ͼ��
��ش��������⣺
��1���жϡ��ϳɡ������У����Ƿ�����ȫ��Ӧ�ķ�����___��
��2��ʵ�����У����˲���Ҫ��һ�����������������С���������ָʢ�б�����Һ����ձ�עҺ�ڽ�����������___��___��
����a����������Ũ������ȴ�ᾧ��������KI���к������ʣ�___��
��3��д�����ϳɡ������У�HCOOH��������ӷ�Ӧ����ʽ��___��
��4���ⶨ��Ʒ��KI�����ķ����ǣ�
a����ȡ3.340g��Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�
b����ȡ25.00mL��Һ����ƿ�У���������KIO3��������ϡ�����ữ����ʹKIO3��KI��Ӧ��ȫ��
c���Ե���Ϊָʾ������0.2400mol/L��Na2S2O3��Һ�ζ���������Һ���ƽ��ֵΪ10.00mL��
��֪��IO3-+I-+H+��I2+H2O��δ��ƽ����I2+2S2O32-��2I-+S4O62-��
�ٲⶨ��������������ʹ��ǰ�������Ƿ�©Һ����___��
�ڸ���Ʒ��KI����������Ϊ___��������3λ��Ч���֣�
��5����ѧ��ѡ�ü�ͥ�����е��йص��ϣ���ƾơ��״ס����͡�ζ���ȣ����ü�㷽��������Ƿ��Ǽӵ�ʳ�Ρ�ͨ��ʵ�������ֳ���ֻҪ��ʳ�ΰ�װ�ķ�ڴ���һ���⻯�ص�����ֽ�����ڴ���ע��ʹ�÷������ܼ�����α��������д�����ʹ��˵����___��
���𰸡�ȡ������Ӧ��Ļ��Һ���Թ��У����뼸�ε�����Һ������Һδ��������֤��������ȫ��Ӧ����֮����δ��ȫ��Ӧ �������¶˽���������ֽ�� ©���¶˼�ڽ����ձ��ڱ� �⻯����ˮ�е��ܽ�����¶ȵ�Ӱ��ϴ� 3HCOOH+IO3-=I-+3H2O+3CO2�� 250mL����ƿ���ζ��� 0.994��99.4% ȡ����ʳ����Ʒ����С�루���������У��������״ף��ÿ��ӽ���Ƭ�̣�Ȼ��պȡҺ�������ֽ�ϣ������ֽ������Ϊ�ӵ��Σ������ǵ���
��������
�ɵ���KOH��Ӧ���ɵ���غ��ü��ỹԭ���������KI��CO2��������ҺpH���˳�ȥ���ʣ���Һ������Ũ������ȴ�ᾧ�����롢����ɵõ��⻯�أ�
(1)���õ��ۼ�����Ƿ���ȫ��Ӧ��
(2)����ʱ��ʢ�б�����Һ����ձ�עҺ�ڽ������������������¶˽���������ֽ����©���¶˼�ڽ����ձ��ڱڣ�����a ����������Ũ������ȴ�ᾧ����˵��KI���ܽ�����¶ȵ�Ӱ��ϴ�
(3)�������֪���ỹԭ���������KI��CO2��ͬʱ����ˮ��
(4)�ⶨ��Ʒ��KI����ʹ������ƿ�͵ζ��ܣ�ʹ��ǰ�������Ƿ�©ˮ����Ϲ�ϵʽ�����㣻
(5)������ֽ��ʳ�������������·�����Ӧ�Ʊ��⣬�����п��ô����ữ��
(1)���õ��ۼ�����Ƿ���ȫ��Ӧ����������Ϊȡ������Ӧ��Ļ��Һ���Թ��У����뼸�ε�����Һ������Һδ��������֤��������ȫ��Ӧ����֮����δ��ȫ��Ӧ��
(2)����ʱ��ʢ�б�����Һ����ձ�עҺ�ڽ������������������¶˽���������ֽ����©���¶˼�ڽ����ձ��ڱڣ�����a ����������Ũ������ȴ�ᾧ����˵��KI���ܽ�����¶ȵ�Ӱ��ϴ�
(3)���ỹԭ���������KI��CO2��ͬʱ����ˮ����Ӧ�����ӷ���ʽΪ3HCOOH+IO3����I��+3H2O+3CO2����
(4)�ٲⶨ��Ʒ��KI����ʹ������ƿ�͵ζ��ܣ�ʹ��ǰ�������Ƿ�©ˮ���ʴ�Ϊ��250mL����ƿ���ζ��ܣ�
��KIO3��KI��Ӧ��ȫ�Ļ�ѧ����ʽΪIO3��+5I��+6H+��3I2+3H2O��
��Ӧ�Ĺ�ϵʽΪ5I����3I2��6S2O32����n(Na2S2O3)��0.2400mol/L��0.01L��2.4��10��3mol��
�ɹ�ϵʽ��֪n(KI)��2.4��10��3mol��![]() ��2��10��3mol��
��2��10��3mol��
��3.340g��Ʒ�к���KI������Ϊ2��10��3mol��![]() ��166g/mol��3.32g��
��166g/mol��3.32g��
����Ʒ��KI����������Ϊ![]() ��0.994��99.4%��
��0.994��99.4%��
(5)������ֽ��ʳ�������������·�����Ӧ�Ʊ��⣬�����п��ô����ữ������Ϊȡ����ʳ����Ʒ����С�루���������У��������״ף��ÿ��ӽ���Ƭ�̣�Ȼ��պȡҺ�������ֽ�ϣ������ֽ������Ϊ�ӵ��Σ������ǵ��Ρ�