题目内容
【题目】下列各项中的离子方程式,书写正确的是 ( )
A.AlCl3水解:Al3++3H2O=Al(OH)3+3H+
B.NaHCO3电离:NaHCO3![]() Na++HCO3-
Na++HCO3-
C.固体Ca(OH)2与NH4Cl共热:NH4++OH-=NH3+H2O
D.过量的CO2气体通入饱和石灰水中:CO2+OH-=HCO3-
【答案】D
【解析】
A项、AlCl3在溶液中水解生成氢氧化铝胶体,使溶液呈酸性,水解的离子方程式为Al3++3H2O![]() Al(OH)3+3H+,故A错误;
Al(OH)3+3H+,故A错误;
B项、NaHCO3是盐,属于强电解质,在溶液中完全电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3=Na++HCO3-,故B错误;
C项、固体Ca(OH)2与NH4Cl共热反应不是在水溶液中进行的,不能改写成离子方程式,故C错误;
D项、过量的CO2气体与饱和石灰水反应生成碳酸氢钙,反应的离子方程式为CO2+OH-=HCO3-,故D正确;
故选D。

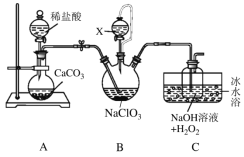
【题目】滴定法是一种重要的定量分析方法,应用范围很广。
(1)下图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
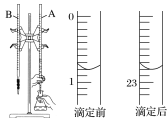
请回答下列问题:
①仪器A的名称是____________。
②盐酸的体积读数:滴定后读数为________mL。
(2)玉溪市场上销售的“白象牌”食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
某学生拟测定食用精制盐的碘(KIO3)含量,其步骤:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全(I2+2S2O32-===2I-+S4O62-)。
①c中指示剂是_______________,判断c中恰好完全反应所依据的现象是___________。
②写出步骤b的离子方程式_____________________。
③b中反应所产生的I2的物质的量是________ mol。
④根据以上实验和包装袋说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_______mg·kg-1。
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果________(填“偏高”“偏低”或“不变”)。