题目内容
【题目】金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,一些水管的活塞会“自动”熔化,喷出水来。由一种铋矿(主要成分为Bi2S3,含强氧化性杂质PbO2等)制备金属铋的简单工艺如图:
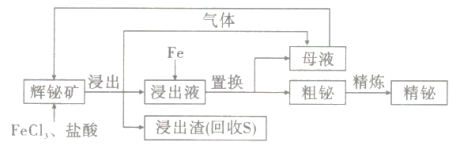
已知:酸性溶液中,氧化性PbO2>KMnO4
回答下列问题:
(1)“浸出”时发生的离子反应包括___、___。
(2)浸出液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是___。
(3)检验母液中主要金属阳离子的方法是___。
(4)乙二胺四乙酸二钠盐(EDTA)可以和Bi3+1:1形成稳定的配合物,一种测定浸出液中Bi3+浓度的方法如下:取25mL浸出液,调节pH=l,滴入2滴二甲酚橙作指示剂(二甲酚橙:溶于水呈亮黄色,能和多种金属阳离子形成紫红色配合物),用0.01000mol/L的EDTA溶液滴定,达到滴定终点时,测得耗去标准液35.00mL,则浸出液中Bi3+的浓度为___g/L,达到滴定终点的现象是__。
(5)以Bi2(SiF6)3的水溶液为电解液,可以实现粗铋的电解精炼。电解过程中,当电路中通过0.3mol电子时,阴极析出的金属Bi的质量为__;电解一段时间后,电解液会有损失,并会出现大量杂质,加入___(填化学式)可以除去该杂质,并使电解液H2SiF6再生。
【答案】PbO2+4H++2Cl-=Pb2++2H2O+Cl2↑ Bi2S3+6Fe3+=2Bi3++3S+6Fe2+ 由于Bi3+发生水解生成H+,如果溶液不保持强酸性,则H+浓度的降低会使Bi3+的水解平衡正向移动,导致生成更多的BiOCl 取少量母液1于试管中,滴加铁氰化钾溶液,若生成蓝色沉淀,则证明有Fe2+ 2.926 当滴入最后一滴EDTA溶液时,溶液由紫红色变为亮黄色,且半分钟内不恢复紫红色 20.9g H2SO4
【解析】
此题利用制备金属铋的工艺流程,考查氧化还原反应、离子反应、离子检验、中和滴定、盐类水解、电解精炼金属的原理,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力。根据流程可知辉铋矿浸出得到气体、浸出渣、浸出液,Bi2S3中的硫被Fe3+氧化为单质硫,所以浸出渣中含单质S,酸性溶液中,氧化性PbO2>KMnO4,加入了盐酸,故气体为氯气,PbO2被还原成Pb2+,浸出液中主要含Bi3+、Pb2+,经Fe置换得到粗铋含Bi、Pb,母液中含Fe2+,粗铋利用电解原理精炼得到精铋。
(1)浸出时发生两个氧化还原反应:PbO2+4H++2Cl-=Pb2++2H2O+Cl2↑、Bi2S3+6Fe3+=2Bi3++3S+6Fe2+
(2)铋能被铁置换,说明其金属性比铁弱,其离子会发生水解,如果溶液不保持强酸性,则Bi3+的水解程度增大,导致生成更多的BiOCl,混入浸出渣使产率降低;
(3)母液中含Fe2+,检验其存在可滴加铁氰化钾溶液,若生成蓝色沉淀,则证明有Fe2+;
(4)乙二胺四乙酸二钠盐(EDTA)和Bi3+1:1形成稳定的配合物,则n(EDTA)=n(Bi3+),得出c(EDTA)V(EDTA)=c(Bi3+)V(Bi3+),0.01000mol/L×0.035L= c(Bi3+)×0.025L,算出
c(Bi3+)=0.014 mol/L=2.926 g/L,达到滴定终点,Bi3+被消耗完全,颜色由紫红色变回亮黄色,故滴定终点为当滴入最后一滴EDTA溶液时,溶液由紫红色变为亮黄色,且半分钟内不恢复紫红色;
(5)以Bi2(SiF6)3的水溶液电解精炼铋,电解过程中,铋的化合价由+3价降到0价,得到3个电子,当电路中通过0.3mol电子时,阴极析出的金属Bi的物质的量为0.1mol,质量为0.1mol×209g/mol=20.9g,粗铋中含有杂质Pb,电解过程中Pb失电子得到Pb2+,除去Pb2+选择SO42-,为使电解液H2SiF6再生,需引入H+,故选择H2SO4。

【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D