题目内容
【题目】甲醛(HCHO)是一种重要的化工产品,工业上可用甲醇脱氢法制备,相关反应方程式为:CH3OH(g) ![]() HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
(1)反应过程中需要向体系中通入空气,通过以下反应提供上述反应所需要的热量:H2(g)+![]() O2(g)=H2O(g) △H=-bkJ/mol
O2(g)=H2O(g) △H=-bkJ/mol
要使反应温度维持在650℃,则进料时,甲醇和空气的体积比应为___(已知空气中氧气的体积分数为20%,b>a)。
(2)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH30H→H+CH2OH(H叫做氢自由基,实际上就是H原子,有很高的反应活性,
“”代表有一个单电子可以参与配对成键)
历程ii:CH2OH→H+HCHO
历程iii:CH2OH→3H+CO
历程iv:自由基发生碰撞形成新化学键而湮灭
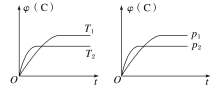
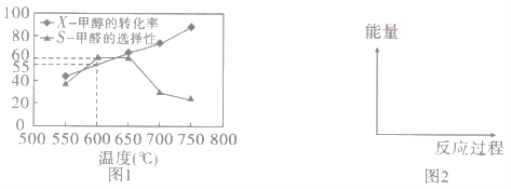
如图1所示为在体积为2L的恒容容器中,投入1molCH3OH(g),在碳酸钠催化剂作用下开始反应,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(副反应仅考虑CH3OH![]() CO+2H2):
CO+2H2):
①请在图2所给坐标中,画出历程iv的反应过程一能量变化示意图___。
②下列说法合理的是__。
a.升高温度,甲醇转化率提高,平衡常数变大
b.当体系气体密度保持不变时,达到平衡状态
c.及时分离产品有利于提高甲醇生成甲醛的转化率
③600℃时,前20min甲醇的平均反应速率为__,此时生成甲醛的反应的Qp=___(Qp的表达式与平衡常数Kp相同,p为物质的分压,分压=总压×物质的量分数,体系初始压强为P0)
④650℃以后,甲醛的选择性降低,而甲醇的转化率升高的可能原因是___。
(3)氧化剂可处理甲醛污染,结合以下图像分析夏季(水温约20℃)应急处理甲醛污染的水源最好应选择的试剂为____。

【答案】![]()
 ac 0.01375mol/(L·min) 0.56P0 温度升高,平衡正向移动,甲醇转化率升高,但由于温度高于650℃后,催化甲醛生成的催化剂催化能力降低,因此甲醛选择性下降 Ca(ClO)2
ac 0.01375mol/(L·min) 0.56P0 温度升高,平衡正向移动,甲醇转化率升高,但由于温度高于650℃后,催化甲醛生成的催化剂催化能力降低,因此甲醛选择性下降 Ca(ClO)2
【解析】
此题利用工业上制备甲醛方法综合考查化学反应原理,考点涉及热量,化学平衡移动,催化反应历程,考查图像解读能力和计算能力。
(1)要使反应温度维持在650℃,应保证放热反应放出的热量恰好被吸热反应全部利用,则甲醇与氧气的物质的量之比为![]() ,相同条件下,物质的量之比等于体积比,故甲醇与氧气的体积之比为
,相同条件下,物质的量之比等于体积比,故甲醇与氧气的体积之比为![]() ,空气中氧气的体积分数为20%,则甲醇与空气的体积之比为
,空气中氧气的体积分数为20%,则甲醇与空气的体积之比为![]() ;
;
(2)①历程iv:自由基发生碰撞形成新化学键而湮灭,自由基具有很高的能量,在形成新化学键时能量降低,且随着不断形成新化学键,自由基浓度减小,能量减低速率减慢,故能量变化示意图为 ;
;
②a.根据图Ⅰ可知,随着温度的升高,甲醇的转化率也在逐渐升高,说明反应往正向进行的程度在增大,K增大,a正确;
b.气体密度= ![]() ,在恒容容器中,总体积保持不变,气体总质量守恒,故气体密度始终不变,不能作为平衡判据,b错误;
,在恒容容器中,总体积保持不变,气体总质量守恒,故气体密度始终不变,不能作为平衡判据,b错误;
c.及时分离产品,平衡将向正向移动,有利于提高甲醇生成甲醛的转化率,c正确;
故合理的为ac;
③600℃、20min时甲醇的转化率为55%,则Δn=0.55mol,平均反应速率v=![]() =
=![]() =0.01375 mol/(L·min),此时甲醛的选择性为60%,则主反应CH3OH(g)
=0.01375 mol/(L·min),此时甲醛的选择性为60%,则主反应CH3OH(g)![]() HCHO(g)+H2(g),得到n1(H2)=n(HCHO)=0.55mol×60%=0.33mol,副反应CH3OH
HCHO(g)+H2(g),得到n1(H2)=n(HCHO)=0.55mol×60%=0.33mol,副反应CH3OH![]() CO+2H2,得到n2(H2)=2n(CO)=2×0.55mol×(1-60%)=0.44mol,n(H2)= n1(H2)+ n2(H2)=0.77mol,在温度一定体积一定的条件下,压强之比等于物质的量之比,甲醛Qp=
CO+2H2,得到n2(H2)=2n(CO)=2×0.55mol×(1-60%)=0.44mol,n(H2)= n1(H2)+ n2(H2)=0.77mol,在温度一定体积一定的条件下,压强之比等于物质的量之比,甲醛Qp= ![]() ==
==![]() = 0.56P0;
= 0.56P0;
④温度升高,平衡正向移动,甲醇转化率升高,但由于温度高于650℃后,催化甲醛生成的催化剂能力降低,因此甲醛选择性下降;
(3)由图像可知,夏季(水温约20℃)时甲醛去除率最高的是Ca(ClO)2,故最好应选择的试剂为Ca(ClO)2。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案