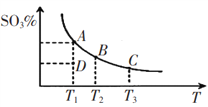
题目内容
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
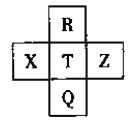
A. 非金属性:Z<T<X
B. R与Q的电子数相差26
C. 气态氢化物稳定性:R<T<Q
D. 最高价氧化物的水化物的酸性:Q>T
【答案】B
【解析】
R单质在暗处与H2剧烈化合并发生爆炸,R为F元素,由元素在周期表中的位置可知,T为Cl元素,Q为Br元素,X为S元素,Z为Ar元素;
A.Z为Ar元素,最外层为稳定结构,金属性与非金属性在同周期中最弱,同周期自左而右金属性减弱,故非金属性Z<X<T,故A错误;
B.R为F元素,Q为Br元素,原子序数相差26,故B正确;
C.同主族自上而下,非金属性减弱,故非金属性F>Cl>Br,非金属性越强,气态氢化物越稳定,故稳定性HF>HCl>HBr,故C错误;
D.同主族自上而下,非金属性减弱,故非金属性Cl>Br,非金属性越强,最高价氧化物的水化物的酸性越强,故酸性:T>Q,故D错误;
故答案为B。

【题目】将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合。达到平衡后溶液呈红色。再将混合液等分为5份,分别进行如下实验:
| 实验①:滴加4滴水,振荡 |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1 mol·L-1 KCl溶液,振荡 | |
实验④:滴加4滴1 mol·L-1 KSCN溶液,振荡 | |
实验⑤:滴加4滴6 mol·L-1 NaOH溶液,振荡 |
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加生成物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验 | 试剂 | 操作及现象 | ||
试管(I) | 试管(II) | |||
(试管容积为50 mL) | 实验a | 1.0 mol·L-1 FeSO4溶液 24 mL | 1.0 mol·L-1 Na2CO3溶液24mL | 倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合 反应过程中无气泡产生,生成白色絮状沉淀 放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀 |
实验b | 1.0 mol·L-1 FeSO4溶液 10 mL | 1.0 mol·L-1 NaHCO3溶液 20 mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色 | |
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。