题目内容
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为______________________________
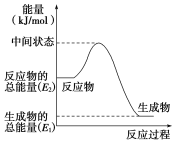
(2)反应②中的能量变化如图所示,该反应为 (吸或放)热反应,ΔH2=________。(用E1、E2表示)
(3)H2(g)的燃烧热为________。
【答案】(1)CH3OH(g)+O2(g)![]() CO2(g)+2H2O(l) △H=-764.7kJ/mol
CO2(g)+2H2O(l) △H=-764.7kJ/mol
(2)放;E1-E2
(3)285.9kJ/mol
【解析】
试题分析:(1)①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
由盖斯定律②+①得到甲醇蒸气完全燃烧的热化学反应方程式为:CH3OH(g)+O2(g)=CO2(g)+2H2O(l) △H=-764.7kJ/mol。
故答案为:CH3OH(g)+O2(g)![]() CO2(g)+2H2O(l) △H=-764.7kJ/mol;
CO2(g)+2H2O(l) △H=-764.7kJ/mol;
(2)反应②中的能量变化如图所示,依据图象分析反应物能量高于生成物能量,所以该反应为放热反应;反应焓变△H=生成物总能量-反应物总能量,△H2=E1-E2。
故答案为:放;E1-E2;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,2H2(g)+O2(g)═2H2O(l)
△H1=-571.8kJ/mol,则氢气燃烧热为285.9KJ/mol。
故答案为:285.9KJ/mol。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案