题目内容
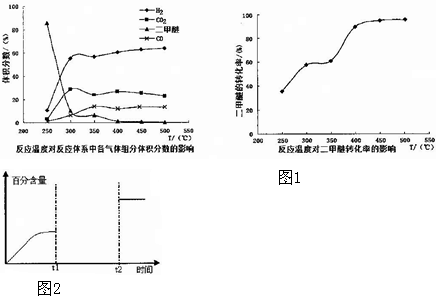
11.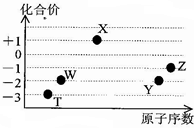 如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )| A. | X的氢化物具有很强的还原性 | |
| B. | YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同 | |
| C. | Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4>H2YO4 | |
| D. | 元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键 |
分析 短周期元素中,W、Y的化合价均有-2价,处于ⅥA族,则Y的原子序数较大,故W为O元素、Y为S元素;
Z有-1价,原子序数大于硫,故Z为Cl;
X有+1价,原子序数大于氧,则X为Na,T有-3价,处于ⅤA族,原子序数小于氧,则T为N元素,据此解答.
解答 解:短周期元素中,W、Y的化合价均有-2价,处于ⅥA族,则Y的原子序数较大,故W为O元素、Y为S元素;Z有-1价,原子序数大于硫,故Z为Cl;X有+1价,原子序数大于氧,则X为Na,T有-3价,处于ⅤA族,原子序数小于氧,则T为N元素.
A.X为Na,其氢化物为NaH,具有很强的还原性,故A正确;
B.SO2、ClO2、Na2O2都能使品红溶液褪色,二氧化硫与有色物质化合为无色物质,而ClO2、Na2O2具有强氧化性,将有色物质氧化为无色物质,褪色原理不相同,故B错误;
C.Y、Z元素的最高价氧化物对应的水化物分别为H2SO4、HClO4,都呈酸性,由于非金属性Cl>S,故酸性:HClO4>H2SO4,故C正确;
D.元素W、T的氢化物分别为H2O、NH3,这两种氢化物分子间存在氢键,它们的沸点比同主族中相邻的氢化物高,故D正确,
故选B.
点评 本题考查结构性质位置关系应用,根据化合价与原子序数推断元素是解题关键,注意对元素化合物性质掌握.

练习册系列答案
相关题目
20.下列物质溶于水中不能形成电解质溶液的是( )
| A. | Na2O2 | B. | NO2 | C. | CH3COOH | D. | CH3CH2OH |
19.短周期元素W、X、Y和Z的原子序数依次增大,其中W的阴离子的核外电子数与X,Y原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用分离液态空气的方法来生产Y的单质,Z与X同族.下列说法中正确的是( )
| A. | 以上四种元素的原子半径大小为WXYZ | |
| B. | X的氢化物与水分子之间可形成氢键 | |
| C. | 已知Z-Cl键能比X-Cl键能小,所以Z的最简单氯化物比X的最简单氯化物沸点低 | |
| D. | W与Y可形成既含共价键又含离子键的化合物 |
3.已知:常温下浓度为0.1mo1•L-1的下列溶液的pH如下表所示:
下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 加热0.1 mol.L-l NaC1O溶液测其pH,pH小于9.7 | |
| B. | 0.lmo1.L-1Na2CO3溶液中,存在如下关系:c(OH-)-c(H+)=c(HCO3)+2c(H2CO3) | |
| C. | 根据上表数据得出四种酸电离平衡常数大小关系为:HF>HC1O>H2CO3(一级电离平衡常数) | |
| D. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合,则有c(Na+)=c(F-)>c(H+)=c(OH-) |
1.下列选项中,离子方程式书写正确的是( )
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O=Ag(NH3)2++2H2O | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O=NH4++HSO3- |