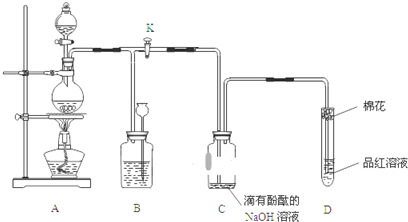
题目内容
12.工业上用CO和H2在一定条件下生产燃料甲醇的反应为:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.
下列说法不正确的是( )
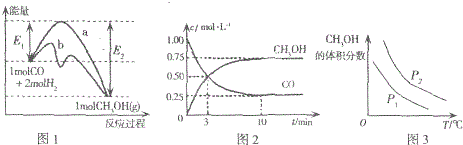
| A. | 图1中曲线b表示使用了催化剂;该反应属于放热反应 | |
| B. | 当压强不同(P1<P2)时,平衡时甲醇的体积分数随温度变化的曲线如图3 | |
| C. | 一定温度下,容器中压强恒定时该反应已达平衡状态 | |
| D. | 该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数为10 |
分析 A.根据催化剂对反应物、生成物的影响及反应物和生成物总能量进行判断;
B.该反应是放热反应,升高温度,平衡逆向移动,甲醇的含量减小,该反应是体积减小的反应,压强越大,甲醇的含量越高;
C.该反应是体积减小的反应,当压强不变时,说明各组分浓度不再变化;
D、根据图2利用三段式可计算出平衡常数.
解答 解:A.在图1中曲线b与a相比,反应物和生成物能量没有变,活化能下降了,说明使用了催化剂,由于生成物能量小于反应能量,所以该反应为放热反应,故A正确;
B.由于该反应是放热反应,升高温度后,平衡逆向移动,甲醇的含量减小,该反应是体积减小的反应,增大压强,甲醇的含量越高,图象与实际相符,故B正确;
C.根据反应可知,该反应是体积减小的反应,当压强不变时,说明正逆反应速率相等,各组分的浓度不再变化,即:该反应已经处于平衡状态,故C正确;
D、根据图2利用三段式可得,
CO(g)+2H2(g)?CH3OH(g).
起始(mol/L) 1 2 0
转化(mol/L) 0.75 1.5 0.75
平衡(mol/L) 0.25 0.5 0.75
所以平衡常数为K=$\frac{0.75}{0.25×0.{5}^{5}}$=12,故D错误;
故选D.
点评 本题主要考查了物质的量或浓度岁时间变化的曲线,题目难度中等,试题涉及反应中的热效应、平衡状态的判断、平衡常数的计算等知识点,解题关键在于能从图象中获取相关信息,试题知识点较多、综合性较强,充分考查了学生灵活应用基础知识的能力.

练习册系列答案
 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
3.已知:常温下浓度为0.1mo1•L-1的下列溶液的pH如下表所示:
下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 加热0.1 mol.L-l NaC1O溶液测其pH,pH小于9.7 | |
| B. | 0.lmo1.L-1Na2CO3溶液中,存在如下关系:c(OH-)-c(H+)=c(HCO3)+2c(H2CO3) | |
| C. | 根据上表数据得出四种酸电离平衡常数大小关系为:HF>HC1O>H2CO3(一级电离平衡常数) | |
| D. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合,则有c(Na+)=c(F-)>c(H+)=c(OH-) |
7.常温常压下,下列表示溶液中粒子浓度或物质的量和各种关系中,正确的是( )
| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+ )=3[c(HC2O4- )+c(C2O42-)+c(H2C2O4)] | |
| B. | pH=4.3的NaHC2O4溶液中:c(Na+ )>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 0.10mol•L-1NaHCO3溶液中:c(Na+ )+c(H+ )=c(OH- )+c(HCO3-)+c(CO32-) | |
| D. | 0.10mol•L-1 NaHCO3溶液加水稀释后,n(H+ )与n(OH- )的乘积不变 |
17.某有机物X的结构简式为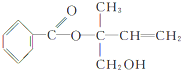 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )
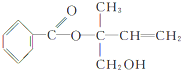 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )| A. | X的分子式为C12H16O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 可用酸性高锰酸钾溶液区分苯和X | |
| D. | 在Ni作催化剂的条件下,1molX最多只能与1molH2加成 |
4.下列叙述中,正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 核外电子总是先排在能量低的电子层上 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
1.下列选项中,离子方程式书写正确的是( )
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O=Ag(NH3)2++2H2O | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O=NH4++HSO3- |