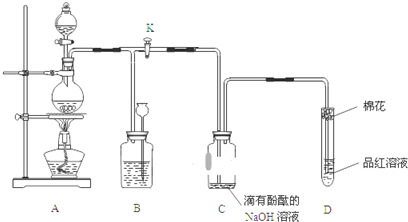
题目内容
14.在限定条件下,对个有机物的同分异构体数目(不考虑立体异构)判断正确的是( )| A | B | C | D | |
| 分子式 | C4H8 | C4H8Cl2 | C4H10O | C5H10O2 |
| 限定条件 | 能发生加成反应 | 只有一个甲基 | 能与钠反应 | 只有一种官能团 |
| 数目 | 3 | 5 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据烯烃的同分异构体的书写方法来回答;
B、丁烷的同分异构体有2种,分别为正丁烷和异丁烷,据此2种碳架结构,结合所给的分子式确定可能有的结构;
C、根据分子式,能和金属钠反应的结构是醇,根据同分异构体的书写方法来判断;
D、C5H10O2能溶于水,只有一个官能团,应该是羧酸类,根据同分异构体的书写方法来判断.
解答 解:A、C4H8能发生加成反应,该有机物属于烯烃,该烯烃的同分异构体:1-丁烯,2-丁烯,2-甲基-1-丙烯三种不同的结构,故A正确;
B、C4H8Cl2中的碳骨架C-C-C-C和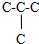 两种,对于C-C-C-C,有三种符合条件的结构,对于
两种,对于C-C-C-C,有三种符合条件的结构,对于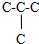 有1种符合条件的结构,共4种,故B错误;
有1种符合条件的结构,共4种,故B错误;
C、根据分子式,能和金属钠反应的结构是醇,丁基有四种结构,且C4H10O属于醇类,它的同分异构体共4种,故C错误;
D、C5H10O2,只有一个官能团,应该是羧酸类,由于丁基的结构有4种,故此分子式的同分异构体有4种,故D错误,故选A.
点评 本题主要考查学生有机物的同分异构体的书写方面的知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
4.设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 1 mol CH4所含质子数目为10NA | |
| C. | 标准状况下22.4 L H2O所含分子数目为NA | |
| D. | 18g NH4+所含电子数目为10NA |
9.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的工艺流程如图:
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是增大反应物的接触面积,提高原料的利用率.该反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应中被氧化的元素是S和Fe.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(3)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl3•6H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
根据表中的数据判断该反应的正向属于放热(填“放热“或”吸热“)反应,理由是压强一定时,温度升高,SO2转化率下降,说明升温平衡逆向移动,则正向放热.
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为7894.7吨(假设反应过程中硫的损失率为5%,结果保留一位小数).

回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是增大反应物的接触面积,提高原料的利用率.该反应的化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应中被氧化的元素是S和Fe.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解;
(3)操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl3•6H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
| 0.1 | 0.5 | 1 | 10 | |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为7894.7吨(假设反应过程中硫的损失率为5%,结果保留一位小数).
19.短周期元素W、X、Y和Z的原子序数依次增大,其中W的阴离子的核外电子数与X,Y原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用分离液态空气的方法来生产Y的单质,Z与X同族.下列说法中正确的是( )
| A. | 以上四种元素的原子半径大小为WXYZ | |
| B. | X的氢化物与水分子之间可形成氢键 | |
| C. | 已知Z-Cl键能比X-Cl键能小,所以Z的最简单氯化物比X的最简单氯化物沸点低 | |
| D. | W与Y可形成既含共价键又含离子键的化合物 |
3.已知:常温下浓度为0.1mo1•L-1的下列溶液的pH如下表所示:
下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 加热0.1 mol.L-l NaC1O溶液测其pH,pH小于9.7 | |
| B. | 0.lmo1.L-1Na2CO3溶液中,存在如下关系:c(OH-)-c(H+)=c(HCO3)+2c(H2CO3) | |
| C. | 根据上表数据得出四种酸电离平衡常数大小关系为:HF>HC1O>H2CO3(一级电离平衡常数) | |
| D. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合,则有c(Na+)=c(F-)>c(H+)=c(OH-) |
4.下列叙述中,正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 核外电子总是先排在能量低的电子层上 | |
| D. | 微粒的最外层只能是8个电子才稳定 |