题目内容
4.有以下一系列反应,最终产物为草酸.A$→_{Br_{2}}^{光}$B$→_{△}^{NaOH醇溶液}$C$\stackrel{溴水}{→}$D$\stackrel{NaOH水溶液}{→}$E $→_{△}^{O_{2}、催化剂}$F$→_{△}^{O_{2}、催化剂}$HOOC-COOH已知B的相对分子质量比A大79,试推断用字母代表的化合物的结构简式.
A是CH3CH3;B是CH3CH2Br;C是CH2═CH2;D是CH2BrCH2Br;E是CH2OHCH2OH;F是OHC-CHO.
分析 E能连续被氧化生成羧酸,从E到HOOCCOOH,反应过程中碳原子个数不变,所以E为CH2OHCH2OH、F为OHCCHO,A光照发生反应生成B,且B比A相对分子质量大79,则A发生取代反应生成B,B发生消去反应生成C,C发生加成反应生成D,则A为烷烃、B为溴代烷、C是烯烃、D是二溴代烷,据此分析解答.
解答 解:E能连续被氧化生成羧酸,从E到HOOCCOOH,反应过程中碳原子个数不变,所以E为CH2OHCH2OH、F为OHCCHO,A光照发生反应生成B,且B比A相对分子质量大79,则A发生取代反应生成B,B发生消去反应生成C,C发生加成反应生成D,这一系列反应碳原子个数不变,所以A、B、C、D分别是CH3CH3、CH3CH2Br、CH2═CH2、CH2BrCH2Br,
故答案为:CH3CH3;CH3CH2Br;CH2═CH2;CH2BrCH2Br;CH2OHCH2OH;OHC-CHO.
点评 本题考查有机物推断,侧重考查学生分析推断能力,涉及烷烃、卤代烃、醇、醛、羧酸之间的转化,明确常见有机反应类型及其反应条件是解本题关键,题目难度不大.

练习册系列答案
相关题目
15.在乙醇发生的各种反应中,断键方式不正确的是( )


| A. | 与钠反应① | B. | 在铜催化下加热①③ | ||
| C. | 在浓硫酸170°C条件下加热②③ | D. | 与HCl反应生成氯乙烷② |
19.下列各组分子中,都属于含有极性键的非极性分子的是( )
| A. | HCl和NH3 | B. | BeCl2和N2 | C. | CH4和C2H4 | D. | CS2和H2O |
9.下列关于工业生产的说法正确的是( )
| A. | 在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 | |
| B. | 在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 | |
| C. | 在氯碱工业,电解槽一般用铁网作电极 | |
| D. | 合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法 |
16.CO2和CH4是两种重要的温室气体,通过化学反应可以将它们转化为其他物质.
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
①该反应的平衡常数表达式为K=$\frac{{c}^{2}(CO){c}^{2}({H}_{2})}{c(C{O}_{2})c(C{H}_{4})}$.
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.

(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
| 温度/℃ | 200℃ | 250℃ | 300℃ |
| 平衡常数/(mol•L-1)2 | K1 | K2 | 80 |
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.
8.下列各组给定原子序数的元素,不能形成原子个数之比为1:1共价化合物的是( )
| A. | 3和17 | B. | 1和8 | C. | 6和8 | D. | 7和12 |

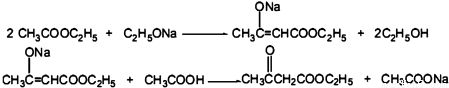
 .
.

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.