题目内容
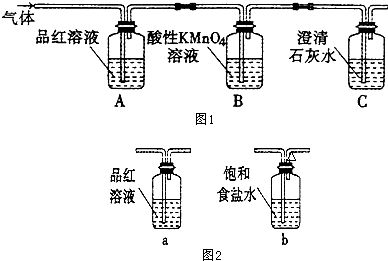
2.某校课外活动小组的同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分.【实验探究】
(l)木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,其中浓H2SO4所起的作用是氧化剂(填“氧化剂”或“还原剂”).若有0.2mol的H2SO4完全参加反应,则消耗碳的质量是1.2g.(碳的摩尔质量为12g•mol-1)
(2)A装置中品红溶液颜色褪色(填“褪色”或“不褪色”),证明含有二氧化硫气体.
(3)B装置的作用是吸收二氧化硫.
(4)C装置中的澄清石灰水是用来检验CO2气体,现象是产生白色沉淀(填“白色”或“黄色”).
【实验讨论】
(5)有同学对B装置能否除尽SO2气体有有疑义,你认为应该在B、C装置之间连接图2中a装置,以确定SO2是否除尽.
【联系实际】
(6)煤和石油的燃烧过程中都有二氧化硫和二氧化碳排放,其中二氧化硫造成的环境影响主要是A,二氧化碳造成的环境影响主要是C.(每空格只填一个选顼)
A.酸雨 B.破坏臭氧层 C.温室效应.
分析 (1)该反应中C元素化合价由0价变为+4价、S元素化合价由+6价变为+4价,所以C作还原剂、浓硫酸作氧化剂;
有2mol浓硫酸参加反应时消耗12gC,根据浓硫酸和C之间的关系式计算消耗C的质量;
(2)二氧化硫具有漂白性,能使品红溶液褪色;
(3)二氧化硫具有还原性,能被强氧化剂高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
(4)二氧化碳属于酸性氧化物,能和氢氧化钙反应生成难溶性白色固体碳酸钙;
(5)二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫;
(6)二氧化硫是形成酸雨的主要成分;二氧化碳是造成温室效应的气体.
解答 解:(1)该反应中C元素化合价由0价变为+4价、S元素化合价由+6价变为+4价,所以C作还原剂、浓硫酸作氧化剂;
有2mol浓硫酸参加反应时消耗12gC,若有0.2mol的H2SO4完全参加反应,则消耗碳的质量是1.2g,
故答案为:氧化剂;1.2;
(2)二氧化硫具有漂白性,能使品红溶液褪色,气体中含有二氧化硫,所以气体通入A装置,看到的现象是品红溶液褪色,故答案为:褪色;二氧化硫;
(3)二氧化硫具有还原性,能被强氧化剂高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以B装置目的是吸收二氧化硫,故答案为:吸收二氧化硫;
(4)二氧化碳属于酸性氧化物,能和氢氧化钙反应生成难溶性白色固体碳酸钙,所以C中看到的现象是产生白色沉淀,故答案为:白色;
(5)二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫,故选a;
(6)二氧化硫是形成酸雨的主要成分;二氧化碳是造成温室效应的气体,
故选A;C.
点评 本题考查性质实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,知道二氧化硫检验方法及性质,注意:二氧化硫、二氧化碳都能使澄清石灰水变浑浊,题目难度不大.

| 化学反应 | 能量转化形式 |
| ①CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | 由 化学能转化为 热能 |
| ②Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | 由 化学能转化为 电能 |
| ③CaCO3$\frac{\underline{\;高温\;}}{\;}$Ca+CO2↑ | 由 热能转化为 化学能 |
| ④6nH2O+6nCO2$→_{叶绿素}^{光}$(C6H12O6)n+6nO2 | 由 光能转化为 化学能 |
| A. | HCl和NH3 | B. | BeCl2和N2 | C. | CH4和C2H4 | D. | CS2和H2O |

(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
| 温度/℃ | 200℃ | 250℃ | 300℃ |
| 平衡常数/(mol•L-1)2 | K1 | K2 | 80 |
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.
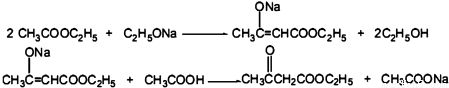

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O. 与
与
 与
与
 与
与
 与
与
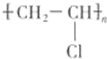 .
.