题目内容
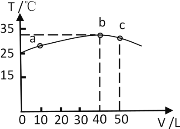
【题目】AlPO4的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A. AlPO4在b点对应的溶解度大于c点
B. AlPO4沉淀溶解是放热的过程
C. 图中四个点的Ksp:a=c=d<b
D. T1温度下,在饱和溶液中加入AlCl3可使溶液由c点变到a点
【答案】B
【解析】
AlPO4沉淀溶解是吸热的过程:AlPO4(s)![]() Al3+(aq)+PO43-(aq)△H>0,温度越高,c(Al3+)、c(PO43-)越大,Ksp越大;温度相同,Ksp相同,在饱和溶液中加入AlCl3,溶液中c(Al3+)增大,c(PO43-)减小。
Al3+(aq)+PO43-(aq)△H>0,温度越高,c(Al3+)、c(PO43-)越大,Ksp越大;温度相同,Ksp相同,在饱和溶液中加入AlCl3,溶液中c(Al3+)增大,c(PO43-)减小。
A项、T2>T1,温度高时溶解度大,则AlPO4在b点对应的溶解度大于c点,故A正确;
B项、沉淀溶解平衡为吸热的过程,故B错误;
C项、温度相同,Ksp相同,温度越高,Ksp越大,则图象中四个点的Ksp:a=d=c<b,故C正确;
D项、T1温度下,Ksp不变,在饱和溶液中加入AlCl3,溶液中c(Al3+)增大,c(PO43-)减小,使溶液由c点变到a点,故D正确。
故选B。

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目