��Ŀ����
����Ŀ��3.20gNaOH����¶���ڿ�����һ��ʱ����ֱ��ʣ�������Ϊ6.24g����ˮ�ܽ⣬����Һ��Ϊ���ȷݣ�һ�ݼ�������Ba(OH)2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����Ƶó�������Ϊ1.97g����һ����εμ�1mol��L1���ᣬ������������ɣ��������30mLʱ����ʼ�������壬���ղ�����״���µ�224mL����(��������ȫ���ݳ�)������˵����ȷ���ǣ� ��
A.�μ�����ʱ����һ����ӦΪCO32-+H+=HCO3-
B.���ʺ����ɷ�ΪNa2CO3��NaHCO3
C.���ʺ������Na2CO3������m(Na2CO3)=1.06g
D.���ʺ������NaOH����������w(NaOH)=25.6%
���𰸡�D
��������
3.20gNaOH����¶���ڿ�����һ��ʱ����ֱ��ʣ�������Ϊ6.24g����ˮ�ܽ⣬����Һ��Ϊ���ȷݣ�һ�ݼ�������Ba(OH)2��Һ������1.97g BaCO3�����������ʵ���Ϊ0.01mol�����ݷ�Ӧ����ʽ��Na2CO3+Ba(OH)2=BaCO3��+2NaOH��n(Na2CO3)=0.01mol����ԭ�������n(Na2CO3)=0.02mol��������Ϊm(Na2CO3)=2.12g����һ�ݼ���1mol��L1HCl���տ�ʼ����������������ķ�ӦΪ��NaOH+HCl=NaCl+H2O��Na2CO3+HCl=NaCl+NaHCO3��������������Ϊ30mL�����ĵ���������ʵ���Ϊ0.03mol�����ż������ᣬ�����ķ�ӦΪ��NaHCO3+HCl=NaCl+CO2��+H2O������0.01molCO2�����ĵ�����Ϊ0.01mol���ܹ�����0.04mol���ᣬNaOH����0.02mol���ᣬ���ݷ�Ӧ����ʽ��NaOH+HCl=NaCl+H2O��n(NaOH)=0.02mol�����ˮ�ܽ��Ļ������n(NaOH)=0.04mol��m(NaOH)=1.6g������̼�����Ƶ�����Ϊ��m(NaHCO3)=(6.24-2.12-1.6)g=3.72g�����Ա��ʺ����ɷ�ΪNaOH��Na2CO3 ��NaHCO3��
A. NaOH����¶���ڿ�����һ��ʱ����ֱ��ʣ����Եμ�����ʱ����һ����ӦΪ��OH-+H+=H2O-��A����
B. �����������������ʺ����ɷ�ΪNaOH��Na2CO3 ��NaHCO3��B����
C. ��ˮ�ܽ⣬����Һ��Ϊ���ȷݣ�һ�ݼ�������Ba(OH)2��Һ��������ӦΪ��Na2CO3+Ba(OH)2=BaCO3��+2NaOH������1.97g BaCO3�����������ʵ���Ϊ0.01mol��Na2CO3�����ʵ���Ϊ0.01mol�����Լ�ˮ�ܽ��Ļ����Һ��Na2CO3�����ʵ���Ϊ0.02mol�����ʺ������Na2CO3������m(Na2CO3)=2.12g��C����
D. ���ʺ������NaOH������Ϊ1.6g��NaOH������������![]() ��D��ȷ���ʴ�Ϊ��D��
��D��ȷ���ʴ�Ϊ��D��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��������ѧԭ����������и���
(1)�ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ǿɼ����Ѻ��¼����γɹ��̡���֪��Ӧ��N2(g)+ 3H2(g)![]() 2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
��ѧ�� | H��H | N��H | N��N |
����/(kJ/mol) | 436 | a | 945 |
(2)25 ��ʱ����a mol/L��ˮ��0.01 mol/L����������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)=c(Cl-)������Һ��________(��ᡱ������С�)�ԡ��ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb��________��
(3)����BaSO4�ı�����Һ��
������Na2SO4��Һ,��c(Ba2+)__________(���������������С����������������ͬ)��
�����ļӸ���Ĺ���BaSO4����c(Ba2+)��__________��
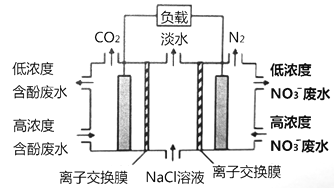
(4)Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��ա�

��ͼ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2������������ClO2�ĵ缫��ӦʽΪ___________��
�����һ��ʱ�䣬�������������������Ϊ112 mL (��״��)ʱ��ֹͣ��⡣ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊ________mol��