题目内容
【题目】元素X形成的气态X2的分子共有三种,其相对分子质量依次为158、160、162,此三种分子的物质的量之比为9:6:1,据此,下列说法中正确的是( )
A.X有三种同位素
B.其中一种同位素的质量数为80
C.X2的平均相对分子质量为159
D.质量数为79的同位素的原子百分数为50%
【答案】C
【解析】
A.元素构成的双原子单质分子有三种,其式量分别为158、160、162,推断该元素存在两种同位素才符合,若是三种同位素则形成的单质应为6种,故A错误;
B.根据双原子单质分子有三种,其式量分别为158、160、162可知,最大的式量为81![]() 2,最小式量为79
2,最小式量为79![]() 2,所以不存在质量数为80的同位素,故B错误;
2,所以不存在质量数为80的同位素,故B错误;
C.X2的平均式量为![]() =159,故C正确;
=159,故C正确;
D.该元素元素的两种同位素的原子设为M、N,构成的双原子单质分子有三种,其式量分别为158、160、162,则原子的同位素只有79、81,形成的单质为79M2、79M81N、81N2,三种单质的物质的量之比为9:6:1,计算质量数为79的同位素原子与质量数为81的同位素原子比为(9![]() 2+6):(6+1
2+6):(6+1![]() 2)=3:1,故质量数为79的同位素原子占原子总数的百分含量为75%,故D错误;
2)=3:1,故质量数为79的同位素原子占原子总数的百分含量为75%,故D错误;
故答案:C。

 阅读快车系列答案
阅读快车系列答案【题目】根据所学原理,完成下列各题
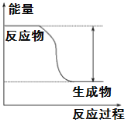
(1)从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应:N2(g)+ 3H2(g)![]() 2NH3(g) △H=﹣93kJ/mol。试根据表中所列键能数据,计算a 的数值为____kJ/mol。
2NH3(g) △H=﹣93kJ/mol。试根据表中所列键能数据,计算a 的数值为____kJ/mol。
化学键 | H﹣H | N﹣H | N≡N |
键能/(kJ/mol) | 436 | a | 945 |
(2)25 ℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
(3)向含有BaSO4的饱和溶液中
①加入Na2SO4溶液,则c(Ba2+)__________(填“变大”、“变小”或“不变”,下同)。
②若改加更多的固体BaSO4,则c(Ba2+)将__________。
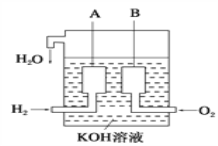
(4)目前已开发出用电解法制取ClO2的新工艺。

①图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________。
②电解一段时间,当阴极产生的气体体积为112 mL (标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。