题目内容
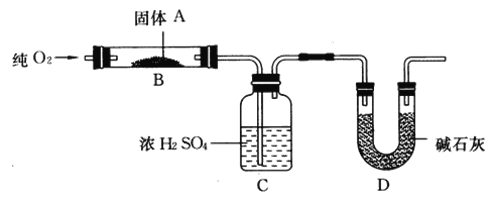
【题目】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂。以氯酸钠(NaC1O3)为原料 制备NaC1O2粗品的工艺流程如下图所示。

己知:①纯C1O2易分解爆炸,空气中C1O2的体积分数在10%以下比较安全。
②NaClO2高于60°C会分解。
(1)反应I的离子方程式为____;反应中需同时鼓入空气的主要目的是____ °
(2)“合成”过程中的氧化剂是______。
(3)蒸发时,需要减压的目的是_____。
(4)“冷却结晶”后获得NaClO,粗产品的操作是_____(填操作名称)。
【答案】2ClO3-+SO2 = 2ClO2+SO42- 稀释ClO2,防止爆炸 ClO2 防止温度过高NaClO2分解 过滤、洗涤、干燥
【解析】
由题给流程可知,酸化的氯酸钠溶液与二氧化硫反应生成硫酸钠、二氧化氯,反应中需同时鼓入空气的主要目的是防止发生反应产生的二氧化氯不稳定易分解爆炸,把它稀释至10%以下安全含量;二氧化氯在氢氧化钠溶液中与过氧化氢反应生成亚氯酸钠、氧气和水;将所得反应液减压蒸发、冷却结晶得到亚氯酸钠粗品。
(1)由题给流程可知,酸化的氯酸钠溶液与二氧化硫反应生成硫酸钠、二氧化氯和水,反应的离子方程式为2ClO3-+SO2 = 2ClO2+SO42-,反应中需同时鼓入空气的主要目的是防止发生反应产生的二氧化氯不稳定易分解爆炸,把它稀释至10%以下安全含量,故答案为:2ClO3-+SO2 = 2ClO2+SO42-;稀释ClO2,防止爆炸;
(2)合成过程中,二氧化氯中氯元素化合价降低被还原,二氧化氯做反应的氧化剂,过氧化氢做反应的还原剂,故答案为:ClO2;
(3)由题意可知,NaClO2高于60°C会分解,则蒸发时,需要减压防止温度过高NaClO2分解,故答案为:防止温度过高NaClO2分解;
(4)得NaClO,粗产品的操作是减压蒸发、冷却结晶、过滤、洗涤、干燥,故答案为:过滤、洗涤、干燥。

【题目】反应2AB+D在四种不同条件下进行,B、D起始浓度为零,A的浓度(molL-1)随反应时间(min)的变化情况如下表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法正确的是
A.在实验1,反应在10至20分钟时间内物质A的平均速率为0.013mol/(Lmin)
B.在实验2,A的初始浓度c2>1.0molL-1
C.设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1
D.实验4中,该反应在30min后才达到平衡状态
【题目】已知:在室温下有以下平衡:
编号 | 平衡方程式 | 平衡常数 |
① | HCNH++CN- | Ka=1×10-10 |
② | H2OH++OH- | Kw=1×10-14 |
③ | CN-+H2OHCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,可用甲基橙做指示剂
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,则该溶液呈碱性
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)
【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
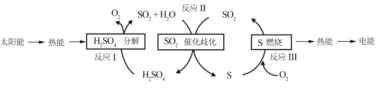
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
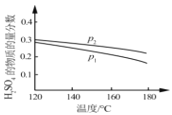
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。