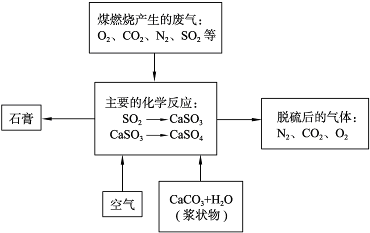
题目内容
从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)海水淡化的方法主要有________(填一种)。
(2)从海水中提取镁的流程如下图所示: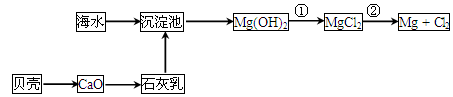
反应①的离子方程式为________________________________________________。
反应②的化学方程式为________________________________________________。
(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为________________________________________________。
(1)蒸馏法、电渗析法、离子交换法(任答一种即可)
(2)Mg(OH)2+2H+=Mg2++2H2O MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
(3)Cl2+2Br-=2Cl-+Br2
解析试题分析:(1)海水淡化的方法主要有蒸馏法、电渗析法、离子交换法(任答一种即可)。(2)由题给流程图知,反应①为氢氧化镁和盐酸反应生成氯化镁和水,离子方程式为Mg(OH)2+2H+=Mg2++2H2O 。反应②为电解熔融氯化镁制金属镁,化学方程式为MgCl2(熔融) Mg+Cl2↑。(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为Cl2+2Br-=2Cl-+Br2。
Mg+Cl2↑。(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为Cl2+2Br-=2Cl-+Br2。
考点:考查海水的综合利用,化学方程式、离子方程式的书写。

 名校课堂系列答案
名校课堂系列答案大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO32-浓度与模拟空气中CO2浓度的关系曲线。下列说法不正确的是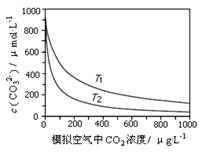
| A.T1>T2 |
| B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,导致CO32-浓度降低 |
| C.当大气中CO2浓度确定时,海水温度越高,CO32- 浓度越低 |
| D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解 |
下列常见金属的冶炼原理中不合理的是
| | 金属 | 冶炼原理 |
| A | Fe | Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
| B | Hg | 2HgO 2Hg+O2↑ 2Hg+O2↑ |
| C | Mg | 2MgO(熔融)  2Mg+O2↑ 2Mg+O2↑ |
| D | Na | 2NaCl(熔融)  2Na+Cl2↑ 2Na+Cl2↑ |
海水资源丰富,海水淡化问题已成为科学家的主要研究方向,若实行海水淡化来供应饮用水,下列方法不正确的是 ( )
| A.利用太阳能,将海水蒸馏淡化 |
| B.加入明矾,使海水的盐份沉淀并淡化 |
| C.通直流电,采用电渗透法使海水淡化 |
| D.通过离子交换膜,除去所含的盐分使海水淡化 |
(11分)从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(一)海水淡化的方法主要有 (只填一种)。
(二)从海水中提取溴和镁的流程如下图所示: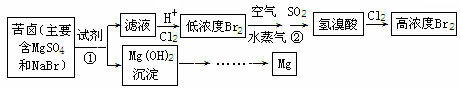
(1)提取Br2时,第一次通入Cl2后发生反应的离子方程式是 ;
②中SO2表现 (填“氧化”或“还原”)性;
第二次通入Cl2后,要提取Br2还要进行的操作为 。
(2)为了实现对镁离子的富集,①中加入的足量试剂是 (填化学式);
请从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是
(填字母)。
A.Mg(OH)2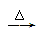 MgO MgO  Mg Mg |
B.Mg(OH)2 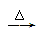 MgO MgO  Mg Mg |
C.Mg(OH)2 无水MgCl2 无水MgCl2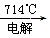 Mg Mg |
D.Mg(OH)2 MgCl2(溶液) MgCl2(溶液) Mg Mg |
【化学选修-化学与技术】(15分)
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程: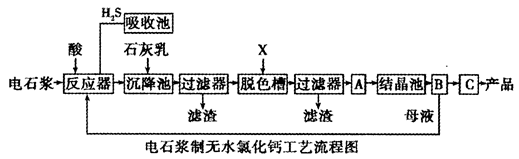
已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
⑴反应器中加入的酸应选用___________________。
⑵脱色槽中应加入的物质X是_______________;设备A的作用是______________;设备B的名称为________________;设备C的作用是____________________。
⑶为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是____________ _。反应的化学方程式为_________________。
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
⑸氯碱工业离子方程式_____________________。
在冶金工业中,均不能用通常化学还原剂制得的金属组是( )
| A.Na、Mg、Al | B.Na、K、Zn、Fe |
| C.Zn、Fe、Cu、Ag | D.Mg、Al、Zn、Fe |