题目内容
在冶金工业中,均不能用通常化学还原剂制得的金属组是( )
| A.Na、Mg、Al | B.Na、K、Zn、Fe |
| C.Zn、Fe、Cu、Ag | D.Mg、Al、Zn、Fe |
A
解析

练习册系列答案
相关题目
下列金属的冶炼不适宜用热还原法来冶炼的是
| A.铁 | B.铜 | C.铅 | D.钠 |
汞(熔点-39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。
下列分析错误的是
A.“灼烧辰砂法”过程中电子转移的方向和数目可表示为: |
| B.辰砂与氧化钙加热反应时,CaSO4为氧化产物 |
| C.洗涤粗汞可用5%的盐酸代替5%的硝酸 |
| D.减压蒸馏的目的是降低汞的沸点,提高分离效率 |
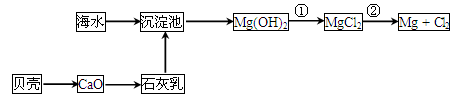
海水中含有氯化镁,是镁的主要来源之一。从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引有海水的水渠中加入石灰乳、沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将得到的产物熔融后电解。关于提取镁,下列说法正确的是 ( )。
| A.此法对环境不会造成任何污染 |
| B.沉降、过滤、洗涤沉淀物操作中既有物理变化也有化学变化 |
| C.若提取12 kg Mg,则电子转移1 000 mol |
| D.以上提取镁的过程涉及的离子反应共有3个 |
诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学反应过程为
①2MoS2+7O2 2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O ③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl ④H2MoO4
2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O ③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl ④H2MoO4 MoO3+H2O
MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是( )。
| A.MoS2煅烧产生的尾气可直接排放 |
| B.MoO3是金属氧化物,也是碱性氧化物 |
| C.H2MoO4是一种强酸 |
| D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2 |
下列说法中,不正确的是( )
| A.金属的冶炼,就是利用氧化还原反应原理,在一定条件下将金属从其化合物中还原出来 |
| B.冶炼金属时,必须加入一种物质作为还原剂 |
| C.金属由化合态变为游离态,都是被还原 |
| D.金属单质被发现和应用得越早,其活动性一般越弱 |
根据海水综合利用的工艺流程图,判断下列说法正确的是
( )
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
| D.在过程④、⑥反应中每氧化0.2 mol Br-需消耗2. 24 L Cl2 |
下列金属的工业制法正确的是( )
| A.制钛:用金属钠置换出氯化钛(TiCl4)溶液中的钛 |
| B.炼铁:用焦炭和空气反应产生的一氧化碳在高温下还原铁矿石中的铁 |
| C.制钠:用海水作原料制得精盐,再电解纯净氯化钠溶液得到金属钠 |
| D.炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜 |