题目内容
16.某一种常见金属X,它既能与盐酸反应,生成X3+和H2,又能与烧碱溶液反应生成[X(OH)4]-和H2O,其氢氧化物具有“两性”,但不与氨水反应;而 Zn(OH)2与氨水反应生成[Zn(NH3)4]2+.试回答下列问题:(1)X处在元素周期表的第三周期,第ⅢA族.
(2)X的氧化物也具“两性”,写出其溶于烧碱溶液的离子方程式Al2O3+2OH-+3H2O=2[Al(OH)4]-.
(3)分离X3+与Zn2+的最佳方法是,加入过量的氨水(写名称).
(4)用阳离子膜法电解Na[X(OH)4]的水溶液得白色沉淀、二种气体等,其离子方程式是4[Al(OH)4]-+2 H2O $\frac{\underline{\;电解\;}}{\;}$ 4Al(OH)3↓+O2↑+2H2↑+4OH-.
(5)与O同周期的第VA族元素Z形成的最常见氢化物也可表示为ZH3,但与XH3最大的区别是:氢元素前者+1,后者-1.Z还可形成多种氢化物及其微粒,如:Z2H4、Z2H5+、ZH4+、ZH2-等等,
①写出Z2H4的电子式
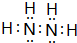 ,六个原子处在同一平面吗?否(是?否?).
,六个原子处在同一平面吗?否(是?否?).②若某一物质组成为Z4H4,则它的一种离子化合物的化学式为NH4N3.
③ZH4+在细菌存在下,氧化成硝酸的离子方程式是NH4++2 O2$\frac{\underline{\;细菌\;}}{\;}$NO3-+2H++H2O.
分析 常见金属X,它既能与盐酸反应,生成X3+和H2,又能与烧碱溶液反应生成[X(OH)4]-和H2O,其氢氧化物具有两性,但不与氨水反应,该金属应该为Al,
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)氧化铝属于两性氧化物,与氢氧化钠反溶液应生成NaAl(OH)4;
(3)氢氧化铝不溶于氨水,而氢氧化锌可以溶于氨水;
(4)用阳离子膜电解Na[X(OH)4]的水溶液得白色沉淀、两种气体:沉淀应为Al(OH)3,气体应该为:H2和O2;
(5)与O同周期的第VA族元素Z应该为N,常见氢化物为NH3,NH3属于共价化合物、AlH3属于离子化合物,H元素化合价化合价不同;
①Z2H4为N2H4 ,分子中N原子与H原子之间形成对共用电子对,N原子之间形成1对共用电子对,两个N都是sp3杂化,周围的空间构型都是三角锥,整个分子就是两个三角锥连起来的,六个原子不处在同一平面;
②N4H4的一种离子化合物应为铵盐;
③NH4+在细菌存在下,被氧气氧化为硝酸,配平书写离子方程式.
解答 解:常见金属X,它既能与盐酸反应,生成X3+和H2,又能与烧碱溶液反应生成[X(OH)4]-和H2O,其氢氧化物具有两性,但不与氨水反应,该金属应该为Al,
(1)Al原子核外有3,个电子层、最外层电子数为3,处于周期表中第三周期ⅢA族,
故答案为:三、ⅢA;
(2)氧化铝属于两性氧化物,具有两性,与氢氧化钠反溶液应生成NaAl(OH)4,反应离子方程式为:Al2O3+2OH-+3H2O=2[Al(OH)4]-,
故答案为:两;Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(3)氢氧化铝不溶于氨水,而氢氧化锌可以溶于氨水,分离Al3+与Zn2+的最佳方法是,加入过量的氨水,
故答案为:氨水;
(4)用阳离子膜电解Na[X(OH)4]的水溶液得白色沉淀、两种气体:沉淀应为Al(OH)3,气体应该为:H2和O2,反应离子方程式为:4[Al(OH)4]-+2 H2O $\frac{\underline{\;电解\;}}{\;}$ 4Al(OH)3↓+O2↑+2H2↑+4OH-,
故答案为:4[Al(OH)4]-+2 H2O $\frac{\underline{\;电解\;}}{\;}$ 4Al(OH)3↓+O2↑+2H2↑+4OH-;
(5)与O同周期的第VA族元素Z应该为N,常见氢化物为NH3,NH3为共价化合物,氢元素显+1价;AlH3为离子化合物,氢元素显-1价,故答案为:+1;-1;
①Z2H4为N2H4 ,分子中N原子与H原子之间形成对共用电子对,N原子之间形成1对共用电子对,电子式为: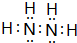 ,两个N都是sp3杂化,周围的空间构型都是三角锥,整个分子就是两个三角锥连起来的,六个原子不处在同一平面,
,两个N都是sp3杂化,周围的空间构型都是三角锥,整个分子就是两个三角锥连起来的,六个原子不处在同一平面,
故答案为: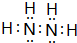 ;否;
;否;
②N4H4的一种离子化合物应为铵盐,化学式为NH4N3,
故答案为:NH4N3;
③NH4+在细菌存在下,被氧气氧化为硝酸,离子方程式为:NH4++2 O2$\frac{\underline{\;细菌\;}}{\;}$NO3-+2H++H2O,
故答案为:NH4++2 O2$\frac{\underline{\;细菌\;}}{\;}$NO3-+2H++H2O.
点评 本题考查属于信息给予题目,涉及Al、Zn、氮及其化合物的性质,较好的对学生获取信息、知识的迁移运用,难度中等.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案| A. | 以焦炭和铁矿石为原料炼铁的原理是用焦炭直接还原化合态的铁 | |
| B. | 据报道,庐江磁性材料产生“磁”力无穷,磁性氧化铁的化学式是Fe2O3 | |
| C. | 为证明某铁矿石中存在铁离子,可将铁矿石溶于硝酸后,再加KSCN溶液 | |
| D. | 利用铁矿石制得的能除去污水中的,可知相同条件下,Ksp(FeS)>Ksp(HgS) |
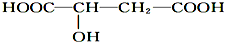 下列相关说法正确的是( )
下列相关说法正确的是( )| A. | 苹果酸在一定条件下能催化氧化生成醛 | |
| B. | 苹果酸在一定条件下能发生取代和消去反应 | |
| C. | 苹果酸在一定条件下能发生加聚反应生成高分子化合物 | |
| D. | 1 mol苹果酸与Na2CO3溶液反应最多消耗1 mol Na2CO3 |
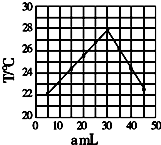 将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )
将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )| A. | 做该实验时,环境温度为22摄氏度 | |
| B. | 该实验表明化学能可能转化为热能 | |
| C. | NaOH溶液的浓度约为0.1mol/L | |
| D. | 该实验表明有水生成的反应都是放热反应 |
| A. | 金属钠在氯气中燃烧制氯化钠 | B. | 氢气和氯气混合经光照制氯化氢 | ||
| C. | 氯气通入澄清石灰水中制漂白粉 | D. | 高温分解石灰石制生石灰 |
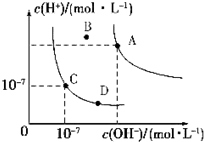
| A. | 水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D) | |
| B. | B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 | |
| C. | 向水中加入醋酸钠固体,可从C点到D点 | |
| D. | 升高温度可实现由C点到D点 |
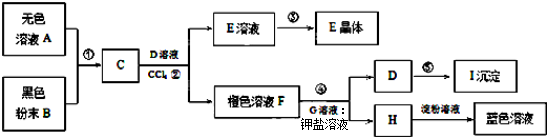
 .
.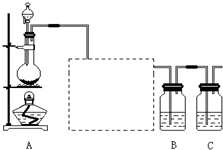 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: