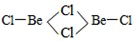
题目内容
5.已知水的电离平衡曲线如图,下列说法正确的是( )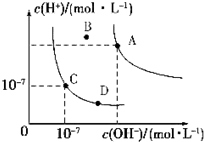
| A. | 水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D) | |
| B. | B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 | |
| C. | 向水中加入醋酸钠固体,可从C点到D点 | |
| D. | 升高温度可实现由C点到D点 |
分析 A.水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的离子积常数越大;
B.B点温度处于A点和C点之间,所以离子积常数大小顺序是Kw(A)>Kw(B)>Kw(C),根据c(H+)和c(OH-)之间的相对大小判断溶液的酸碱性;
C.温度不变,Kw不变,从C点到D点c(OH-)变大,c(H+)变小;
D.C点溶液呈中性,D点溶液呈碱性.
解答 解:A.水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的离子积常数越大,
依据图象分析可知,水的离子积常数关系为:kW(A)>kW(B)>kW(C)=kW(D),故A错误;
B.B点温度处于A点和C点之间,所以离子积常数大小顺序是Kw(A)>Kw(B)>Kw(C),B点温度下,pH=4的硫酸与pH=10的氢氧化钠溶液中c(H+)<c(OH-),等体积混合后溶液呈碱性,但pH不一定等于7,故B错误;
C.温度不变,Kw不变,向水中加入醋酸钠固体,溶液中c(OH-)变大,c(H+)变小,所以可以实现从C点到D点,故C正确;
D.C点溶液呈中性,D点溶液呈碱性,所以不能通过升高温度实现由C点到D点,故D错误;
故选C.
点评 本题考查离子积常数、水的电离,侧重考查学生分析判断能力,为高考高频点,明确图象中各点含义是解本题关键,注意离子积常数只与温度有关,与溶液酸碱性无关,题目难度中等.

 阅读快车系列答案
阅读快车系列答案金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
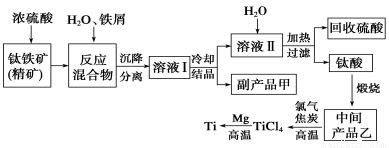
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲阳离子是________。
(2)上述生产流程中加入铁屑的目的是____________________________。
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol·L-1,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:________________________。
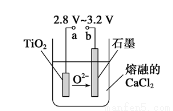
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是__________________。(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图所示。下图中b是电源的________极,阴极的电极反应式________。
| A. | 灼烧CsCl时,火焰有特殊的颜色 | |
| B. | CsNO3易溶于水 | |
| C. | 在钠、钾、铯三种单质中,钠的熔点最低 | |
| D. | CsOH是弱碱 |
| A. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 某吸热反应能自发进行,因此该反应是熵增反应 |
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 金属钠和水的反应:Na+2H2O=H2↑+Na++2OH- | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+=Al3++3H2O | |
| D. | Ba(OH)2溶液中加入稀H2SO4:Ba2++SO42-=BaSO4↓ |
 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”); 常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-═Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
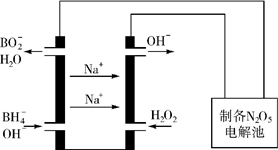
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
| A. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| B. | 用福尔马林保鲜鱼肉等食品对人体有害 | |
| C. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型不同 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
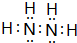 ,六个原子处在同一平面吗?否(是?否?).
,六个原子处在同一平面吗?否(是?否?).