题目内容
6.在饱和碳酸钠溶液中通入CO2,将所得溶液小心蒸干,得到固体A,为分析A的成分,设计如下实验方案.(1)甲实验:用pH计检验A是否为纯净的碳酸氢钠.25℃时,将一定质量的样品A溶于水配成溶液测其pH,还需另一种试剂和水进行对照实验,该试剂是纯净的碳酸氢钠.
 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
(3)丙实验:称取0.736g样品,配置成100mL溶液,取出20.00mL,用0.1000mol/L的盐酸滴定,可用甲基橙作指示剂,终点颜色的变化是黄色变为橙色且半分钟不褪色.
(4)丁实验:通过受热质量分析法测定A是否为纯净的碳酸氢钠,取10.000g样品置于坩埚(填写仪器名称)中加热,经干燥、冷却、称量固体质量,上述操作步骤至少进行2次,当剩余固体质量为6.310克(保留3位小数)时,证明A为纯净的碳酸氢钠固体.
分析 (1)对照实验是测定溶液PH判断是否为纯净的碳酸氢钠,需要对比纯净的碳酸氢钠溶液的PH分析判断;
(2)图中数据分析,碳酸氢钡浓度越大越易析出沉淀;
(3)用盐酸滴定A样品的溶液用甲基橙作指示剂时,滴入最后一滴盐酸溶液,反应达到终点溶液颜色由黄色变化为橙色且半分钟不变,证明反应达到终点;
(4)固体受热分解在坩埚中加热,利用加热前后质量变化结合化学方程式定量关系计算分析判断;
解答 解:(1)对照实验是测定溶液PH判断是否为纯净的碳酸氢钠,需要对比纯净的碳酸氢钠水溶液溶液的PH分析,所以需要纯净的碳酸氢钠和水,测定纯净碳酸钠溶于水形成溶液PH,与A溶于水测定溶液PH对比,若相同证明A为纯净的碳酸氢钠,否则不是;
故答案为:纯净的碳酸氢钠;
(2)图中数据分析,产生浑浊的原因可能是A中含有碳酸钠和氯化钡反应生成沉淀,也可能是碳酸氢钡随浓度增大会析出沉淀,碳酸氢钡浓度增大析出沉淀;
故答案为:碳酸氢钡浓度增大析出沉淀;
(3)用盐酸滴定A样品的溶液用甲基橙作指示剂时,PH变色范围为3.1-4.4,溶液PH小于3.1呈红色,3.1-4.4溶液呈橙色,大于4.4溶液呈黄色,滴入最后一滴盐酸溶液,反应达到终点溶液颜色由黄色变化为橙色且半分钟不变,证明反应达到终点;
故答案为:黄色变为橙色且半分钟不褪色;
(4)固体受热分解需要在坩埚中加热,为实验的准确性,需要重复加热、干燥、冷却、称量固体质量,操作最少需要2次,称量至恒重,利用加热前后质量变化结合化学方程式定量关系计算分析判断,若10g全部是纯净的碳酸氢钠,受热分解后固体质量为x
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
2×84 106
10g x
x=6.310g
取10.000g样品加热分解、干燥、冷却、称量固体质量为6.310g,说明A为纯净的碳酸氢钠;
故答案为:坩埚,2,6.310g.
点评 本题考查了物质组成的实验检测方法和实验设计,主要是物质性质,滴定实验和化学方程式的计算应用,掌握基础是关键,题目难度中等.

 优加精卷系列答案
优加精卷系列答案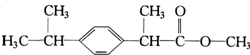 关于有机物X的说法中,错误的是( )
关于有机物X的说法中,错误的是( )| A. | X难溶于水,易溶于有机溶剂 | B. | 1molX能跟4 mol氢气发生加成反应 | ||
| C. | X能使酸性高锰酸钾溶液褪色 | D. | X的水解产物不能发生消去反应 |
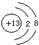 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 该元素原子的原子核外有2个电子层 | |
| B. | 该元素是一种金属元素 | |
| C. | 该粒子是阳离子 | |
| D. | 该粒子具有稳定结构 |
| A. | 3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 2c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) | |
| C. | c(K+)>c(Na+)>c(HCO3-)+c(CO32-)>c(OH-)>c(H+) | |
| D. | c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1 mol•L-1 |
HX(aq)?X-(aq)+H+(aq)△H>0 K=10-a
X-(aq)+H2O?HX(aq)+OH-(aq)△H>0 k=10-b
下列有关浓度均为0.1mol•L-1HX溶液和NaX溶液的叙述正确的是( )
| A. | 分别对两溶液微热时,K均增大、溶液pH均减小 | |
| B. | 恒温下分别稀释两溶液时,K均不变、溶液pH均增大 | |
| C. | 25℃时a+b=14 | |
| D. | 25℃时两溶液混合所得pH=8的溶液中,c(X-)>c(Na+) |
| A. | 嘴嚼米饭时有甜味(化学变化) | |
| B. | 玻璃窗破裂(化学变化) | |
| C. | 二氧化碳使澄清的石灰水变浑浊(物理变化) | |
| D. | 纯净物加热后变为混合物(物理变化) |
| A. | 硝酸钾和氯化钠的混合物 | B. | 溴水 | ||
| C. | 汽油和柴油 | D. | 四氯化碳和水 |
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
(2)实验室制取YW3的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)R2X2与W2X反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(4)写出铁在高温下与W2X反应生成磁性物质并产生W2气的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑.
(5)由W,R,X三种元素形成的离子化合物是强碱,写出它与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
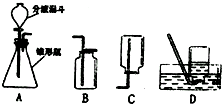 过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:
过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题: