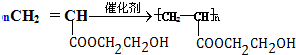题目内容
1.已知在25℃时,水溶液中如下两个可逆过程的热效应及平衡常数如下(HX为一元酸):HX(aq)?X-(aq)+H+(aq)△H>0 K=10-a
X-(aq)+H2O?HX(aq)+OH-(aq)△H>0 k=10-b
下列有关浓度均为0.1mol•L-1HX溶液和NaX溶液的叙述正确的是( )
| A. | 分别对两溶液微热时,K均增大、溶液pH均减小 | |
| B. | 恒温下分别稀释两溶液时,K均不变、溶液pH均增大 | |
| C. | 25℃时a+b=14 | |
| D. | 25℃时两溶液混合所得pH=8的溶液中,c(X-)>c(Na+) |
分析 A、HX的电离和X-的水解都是吸热反应,升温平衡正向移动;
B、加水稀释溶液,溶液酸碱性减弱;
C、Kw只受温度影响,HX的电离平衡常数和X-的水解平衡常数乘积等于Kw;
D、25℃时pH=8的溶液显碱性,据电荷守恒分析.
解答 解:A、升温HX的酸性增强,pH减小,NaX溶液的碱性增强,pH增大,故A错误;
B、加水稀释,HX的酸性减弱,pH增大,NaX溶液的碱性减弱,pH减小,故B错误;
C、HX的电离平衡常数和X-的水解平衡常数乘积等于Kw,所以25℃a+b=14,故C正确;
D、25℃时pH=8的溶液显碱性,溶液中c(Na+)>c(X-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了弱酸的电离平衡和弱酸根离子的水解平衡移动的影响因素以及离子浓度大小的比较,题目难度不大.

练习册系列答案
相关题目
16.常温下,对pH=10的氨水而言,下列说法正确的是( )
| A. | 溶液中由水电离的氢离子浓度为10-4 | |
| B. | 与pH=4的盐酸等体积混合后,c(Cl-)>c(NH4+) | |
| C. | 通入一定量氨气后,依然存在c(NH4+)+c(H+)=c(OH-) | |
| D. | 氨水中存在:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
6.在饱和碳酸钠溶液中通入CO2,将所得溶液小心蒸干,得到固体A,为分析A的成分,设计如下实验方案.
(1)甲实验:用pH计检验A是否为纯净的碳酸氢钠.25℃时,将一定质量的样品A溶于水配成溶液测其pH,还需另一种试剂和水进行对照实验,该试剂是纯净的碳酸氢钠.
(2)乙实验:将A配成溶液与BaCl2溶液等体积混合,通过观察实验现象判断A是否为纯净的碳酸氢钠,下表是几组实验的现象:产生浑浊的原因可能是①A中含有碳酸钠;②碳酸氢钡溶液密度增大析出沉淀.
(3)丙实验:称取0.736g样品,配置成100mL溶液,取出20.00mL,用0.1000mol/L的盐酸滴定,可用甲基橙作指示剂,终点颜色的变化是黄色变为橙色且半分钟不褪色.
(4)丁实验:通过受热质量分析法测定A是否为纯净的碳酸氢钠,取10.000g样品置于坩埚(填写仪器名称)中加热,经干燥、冷却、称量固体质量,上述操作步骤至少进行2次,当剩余固体质量为6.310克(保留3位小数)时,证明A为纯净的碳酸氢钠固体.
(1)甲实验:用pH计检验A是否为纯净的碳酸氢钠.25℃时,将一定质量的样品A溶于水配成溶液测其pH,还需另一种试剂和水进行对照实验,该试剂是纯净的碳酸氢钠.
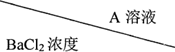 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
(3)丙实验:称取0.736g样品,配置成100mL溶液,取出20.00mL,用0.1000mol/L的盐酸滴定,可用甲基橙作指示剂,终点颜色的变化是黄色变为橙色且半分钟不褪色.
(4)丁实验:通过受热质量分析法测定A是否为纯净的碳酸氢钠,取10.000g样品置于坩埚(填写仪器名称)中加热,经干燥、冷却、称量固体质量,上述操作步骤至少进行2次,当剩余固体质量为6.310克(保留3位小数)时,证明A为纯净的碳酸氢钠固体.
10.下列实验设计方案中,可行的是( )
| A. | 用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO42- | |
| D. | 先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
11.下列方程式正确的是( )
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3(浓)═Fe(NO3)3+3NO2↑+3H2O | |
| B. | 向氯化铵的稀溶液中加入少量NaOH:NH4++OH-═NH3↑+H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
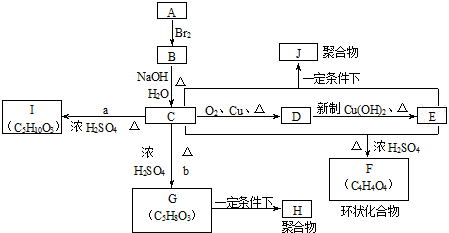
 ;指出C→G的反应类型酯化(取代)反应.
;指出C→G的反应类型酯化(取代)反应.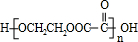 +(2n-1)H2O
+(2n-1)H2O