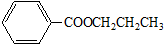题目内容
1.下列操作或装置能达到实验目的是( )| A. | 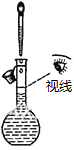 配置一定浓度的NaCl溶液 | B. | 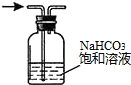 除去氯气中的HCl气体 | ||
| C. | 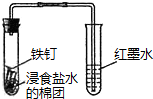 观察铁的吸氧腐蚀 | D. | 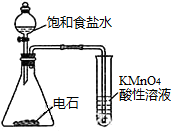 检验乙炔的还原性 检验乙炔的还原性 |
分析 A.依据定容时眼睛应平视刻度线解答;
B.除去杂质不能引入新的杂质;
C.铁在食盐水中发生吸氧腐蚀;
D.生成的乙炔中含有H2S、PH3等还原性气体.
解答 解:A.配制一定物质的量浓度溶液时,定容时眼睛应平视刻度线,故A错误;
B.饱和碳酸氢钠溶液能够与氯化氢反应生成二氧化碳,引入新的杂质,应改用饱和氯化钠溶液,故B错误;
C.氯化钠溶液呈中性,铁在食盐水中发生吸氧腐蚀,在酸性条件下发生析氢腐蚀,故C正确;
D.生成的乙炔中含有H2S、PH3等还原性气体,应将杂质除去方能证明乙炔的还原性,故D错误;
故选:C.
点评 本题为实验题,考查了实验基本操作及设计,明确实验原理及仪器使用方法即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.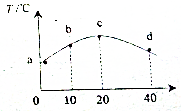 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(NO2-)+c(HNO2) | |
| C. | c点混合溶液中:c(Na+)>c(OH-)>c(NO2)>c(H+) | |
| D. | d点混合溶液中:c(OH-)=c(HNO2)+c(H+) |
12. C、N、O、Al、Si、Cu是常见的六种元素.
C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元素周期表第三周期第IVA族;
(2)N的基态原子核外电子排布式为1s22s22p3;Cu的基态原子最外层有1个电子;
(3)用“>”或“<”填空:
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动.t1时,原电池中电子流动方向发生改变,其原因是Al在浓硝酸中发生钝化,氧化膜阻止了Al的进一步反应.
 C、N、O、Al、Si、Cu是常见的六种元素.
C、N、O、Al、Si、Cu是常见的六种元素.(1)Si位于元素周期表第三周期第IVA族;
(2)N的基态原子核外电子排布式为1s22s22p3;Cu的基态原子最外层有1个电子;
(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动.t1时,原电池中电子流动方向发生改变,其原因是Al在浓硝酸中发生钝化,氧化膜阻止了Al的进一步反应.
9.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性:Na2CO3>NaHCO3 |
6.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 烧结粘土制陶瓷 | D. | 打磨磁石制指南针 |
8.下列说法正确的是( )
| A. | pH=5的NH4Cl溶液或醋酸溶液中,由水电离出的c(H+)均为10-9mol•L-1 | |
| B. | 常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |

 .
. .
.
 .
. .
. B.
B.