题目内容
6.X、Y、Z是周期表中三种相邻的短周期元素,它们的原子序数依次增大,三种元素的原子最外层电子数之和为17.下列说法正确的是( )| A. | X、Y、Z三种元素在周期表中处于同一周期 | |
| B. | 同主族元素中的X的气态氢化物最稳定 | |
| C. | 同一周期元素中Z的最高价氧化物对应的水化物酸性最强 | |
| D. | Y、Z所形成的化合物属于酸性氧化物 |
分析 X、Y、Z是周期表中三种相邻的短周期元素,它们的原子序数依次增大,三种元素的原子最外层电子数之和为17,设X的最外层电子数为x,
若三种元素在同一周期,则Y的最外层电子数为x+1,Z的最外层电子数为x+2,所以x+x+1+x+2=17,即x=$\frac{14}{3}$,电子数为不能为分数,不符合题意;
若X、Z同主族,X、Y同周期,则X、Z最外层电子数均为x,Y的最外层电子数为x+1,所以x+x+x+1=17,即x=$\frac{16}{3}$,电子数为不能为分数,不符合题意;
若X、Y同主族,Y、Z同周期,则X、Y最外层电子数均为x,Z的最外层电子数为x+1,所以x+x+x+1=17,即x=$\frac{16}{3}$,电子数为不能为分数,不符合题意;
若X、Y同周期,Y、Z同主族,则Y、Z最外层电子数均为x,X的最外层电子数为x-1,所以x+x+x-1=17,即x=6,则Y为O元素,Z为S元素,X为N元素,结合元素周期律解答.
解答 解:X、Y、Z是周期表中三种相邻的短周期元素,它们的原子序数依次增大,三种元素的原子最外层电子数之和为17,设X的最外层电子数为x,
若三种元素在同一周期,则Y的最外层电子数为x+1,Z的最外层电子数为x+2,所以x+x+1+x+2=17,即x=$\frac{14}{3}$,电子数为不能为分数,不符合题意;
若X、Z同主族,X、Y同周期,则X、Z最外层电子数均为x,Y的最外层电子数为x+1,所以x+x+x+1=17,即x=$\frac{16}{3}$,电子数为不能为分数,不符合题意;
若X、Y同主族,Y、Z同周期,则X、Y最外层电子数均为x,Z的最外层电子数为x+1,所以x+x+x+1=17,即x=$\frac{16}{3}$,电子数为不能为分数,不符合题意;
若X、Y同周期,Y、Z同主族,则Y、Z最外层电子数均为x,X的最外层电子数为x-1,所以x+x+x-1=17,即x=6,则Y为O元素,Z为S元素,X为N元素,
A.由分析可知,X、Y、Z三种元素在周期表中不在同一周期,故A错误;
B.元素的非金属越强,其氢化物的稳定性越强,这三种元素中非金属性最强的是Y,为O元素,故B错误;
C.Z是S元素,同一周期元素中最高价氧化物对应的水化物酸性随着原子序数的增大而增强,所以第三周期中Cl元素的最高价氧化物对应的水化物酸性最强,故C错误;
D.Y为O元素,Z为S元素,二者形成的化合物有SO2、SO3,二者均为酸性氧化物,故D正确.
故选D.
点评 本题考查位置结构性质的相互关系应用,题目难度中等,本题注意把握如何从电子排布和元素位置的角度推断元素的种类,学习中注重把握元素周期律的主要内容.

已知有机物A为饱和多元醇,可由饱和多卤代烃水解得到.为研究A的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)纯净的A为无色粘稠液体, 易溶于水,沸点为380.4℃ | (1)将A从它的水溶液里分离出来 的操作方法是蒸馏. |
| (2)将13.6gA在20.0L纯O2(过量)中充分燃烧 并使反应后的气体依次缓缓通过浓硫酸和碱石灰后, 测得气体体积分别为17.76L和6.56L (所有气体体积均在标准状况下测定). | (2)A的实验式为C5H12O4, A的分子式为C5H12O4. |
(3)A的核磁共振氢谱如图: | (3)A中含有2种氢原 子,A的键线式为 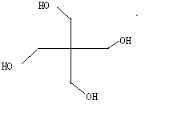 . . |
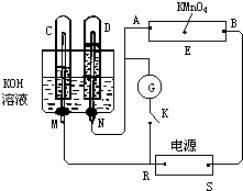
| A. | CH4在负极发生氧化反应 | |
| B. | 工作一段时间后,电解质溶液中KOH的物质的量减少 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 该电池工作时,X极附近溶液的碱性增强 |
| A. | 电解法、热分解法、热还原法 | B. | 热分解法、电解法、热还原法 | ||
| C. | 热还原法、热分解法、热还原法 | D. | 电解法、电解法、热分解法 |
| A. | 升高温度 | B. | 增大B的浓度 | ||
| C. | 增大压强 | D. | 使用合适的催化剂 |
| A. | SO32-的空间构型为平面三角形 | |
| B. | SiO2晶体中,最小的环上有6个Si原子和6个O原子 | |
| C. | CuSO4•5H2O中Cu的配位数为4 | |
| D. | SnBr2分子中Sn-Br的键角为120° |
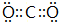 ;
;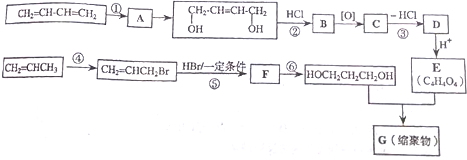
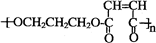 +2nH2O
+2nH2O