题目内容
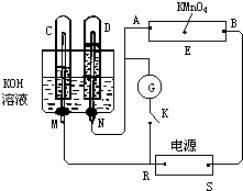
10.如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生.(1)外电源的正、负极分别是R负极S为正极.
(2)A附近溶液的现象是溶液变红,B附近发生的电极反应式为4OH--4e-=2H2O+O2↑
(3)滤纸上的紫色点向哪方移动紫色向B方向移动.
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为氢气和氧气构成燃料电池,有关的反应式为负极:2H2+4OH--4e-=4H2O;正极:O2+2H2O+4e-=4OH-_.
分析 (1)根据C、D两电极得到的气体体积判断电极名称,从而确定电源R、S电极名称;
(2)先判断A、B 的电极名称,根据电解池的工作原理来书写电极反应式;
(3)根据电解池的工作原理判断电解时溶液中离子的移动方向;
(4)根据原电池中燃料电池的工作原理和规律来回答;
解答 解:(1)闭合K,通直流电,电极C、D及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,C极上气体体积是D极上气体体积的2倍,所以C极上得氢气,D极上得到氧气,故R是负极,S是正极,所以B极是阳极,A极是阴极.
故答案为:负极;正极;
(2)A极是阴极,电解高锰酸钾时,在该极上放电的是氢离子,所以该极上碱性增强,酚酞显红色,B极是阳极,该极附近发生的电极反应式为:4OH--4e-=2H2O+O2↑,故答案为:溶液变红;4OH--4e-=2H2O+O2↑;
(3)浸有高锰酸钾的滤纸和电极A、B与电源也构成了电解池,因为R是负极,S是正极,所以B极是阳极,A极是阴极,电解质溶液中的阴离子高锰酸跟离子向阳极移动,所以B极呈紫色,
故答案为:紫色向B方向移动;
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,构成氢氧燃料电池,在燃料电池中,燃料氢气为负极,方程式为2H2+4OH--4e-=4H2O;
氧气作正极,方程式为O2+2H2O+4e-=4OH-;
故答案为:氢气和氧气构成燃料电池;负极:2H2+4OH--4e-=4H2O;正极:O2+2H2O+4e-=4OH-;
点评 本题考查了原电池、电解池工作原理,会根据电池反应式及元素化合价变化书写正负极电极反应式,再结合各个物理量之间的关系式进行计算,题目难度中等.

练习册系列答案
相关题目
6.X、Y、Z是周期表中三种相邻的短周期元素,它们的原子序数依次增大,三种元素的原子最外层电子数之和为17.下列说法正确的是( )
| A. | X、Y、Z三种元素在周期表中处于同一周期 | |
| B. | 同主族元素中的X的气态氢化物最稳定 | |
| C. | 同一周期元素中Z的最高价氧化物对应的水化物酸性最强 | |
| D. | Y、Z所形成的化合物属于酸性氧化物 |
7.化学知识渗透到人类生活的各个方面.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 油脂和汽油都属于酯类,都能用作工业制肥皂 | |
| C. | 纯碱可用于生成普通玻璃,日常生活中也可能用初年溶液来除去物品表面的油污 | |
| D. | 雾霾严重影响了人们的正常生活,为改善空气质量,可以加高工厂的烟囱,使灰尘和废气远离地表 |
15.下列有关物质性质的叙述正确的是( )
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | SO2具有氧化性,可用于漂白纸浆 | |
| C. | 氯化铝是一种电解质,可用于电解法制铝 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
2.下列说法不正确的是( )
| A. | 硅是半导体材料,可用于制备光导纤维 | |
| B. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
20.下列物质的分类错误的是( )
| A. | 水、二氧化硫和干冰都属氧化物 | B. | H2SO4、HNO3和H2CO3都属于酸 | ||
| C. | KNO3、CuSO4和NH4Cl都属于盐 | D. | 烧碱、纯碱、熟石灰都属于碱 |
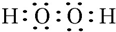 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
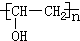 ;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;
;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;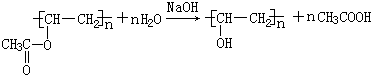 .
.