题目内容
16.研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式.已知有机物A为饱和多元醇,可由饱和多卤代烃水解得到.为研究A的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)纯净的A为无色粘稠液体, 易溶于水,沸点为380.4℃ | (1)将A从它的水溶液里分离出来 的操作方法是蒸馏. |
| (2)将13.6gA在20.0L纯O2(过量)中充分燃烧 并使反应后的气体依次缓缓通过浓硫酸和碱石灰后, 测得气体体积分别为17.76L和6.56L (所有气体体积均在标准状况下测定). | (2)A的实验式为C5H12O4, A的分子式为C5H12O4. |
(3)A的核磁共振氢谱如图: | (3)A中含有2种氢原 子,A的键线式为 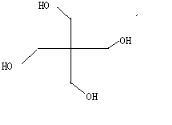 . . |
分析 (1)A的沸点为380.4℃,与水的沸点相差较大,可以采用蒸馏的方法分离;
(2)浓硫酸可以吸收水,碱石灰可以吸收二氧化碳,根据元素守恒来确定有机物的分子式;
(3)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子,峰面积之比等于氢原子的数目之比,据此解答即可.
解答 解:(1)由于有机物A的沸点与水的沸点相差较大,故可以采用蒸馏的方法分离,故答案为:蒸馏;
(2)通过浓硫酸和碱石灰后气体体积仍为6.56L,此为剩余的氧气,说明发生反应的氧气的物质的量=$\frac{20L-6.56L}{22.4L/mol}$=0.6mol,通过浓硫酸后气体体积为17.76L,通过碱石灰后体积为6.56L,此间减小的气体应为二氧化碳,物质的量为:$\frac{17.76L-6.65L}{22.4L/mol}$=0.5mol,A为多元醇,设分子式为:CnH2n+2Oy,燃烧方程式为:CnH2n+2Oy+$\frac{3n+1-y}{2}$O2$\stackrel{点燃}{→}$nCO2+(n+1)H2O,由题意得出A完全燃烧,即$\left\{\begin{array}{l}{\frac{13.6g}{12n+2n+2+16y}:0.6=1:\frac{3n+1-y}{2}}\\{\frac{\frac{3n+1-y}{2}}{0.6}=\frac{n}{0.5}}\end{array}\right.$,解n=5,y=4,即分子式为:C5H12O4,实验式即为其分子式,故答案为:C5H12O4;C5H12O4;
(3)根据核磁共振氢谱图看出有机物中有2个峰值,则含2种类型的等效氢原子,且峰面积比为1:2,据此得出A的键线式为: ,故答案为:2;
,故答案为:2; .
.
点评 本题是一道关于有机物的结构和性质知识的综合推断题,考查学生对知识的整合能力,难度较大.

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 用饱和Na2CO3 溶液除去CO2中含有的HCl | |
| B. | 往白色ZnS沉淀中滴加CuSO4溶液,沉淀变黑,证明:Ksp(CuS)<Ksp(ZnS) | |
| C. | 进行酸碱中和滴定时,眼睛要注视滴管液面的变化 | |
| D. | 中和热测定实验时,应将NaOH溶液缓慢倒入盐酸中 |
| A. |  制备氢氧化亚铁并观察其颜色 | B. |  碳酸、苯酚酸性强弱比较 | ||
| C. |  制备并收集少量NO2气体 | D. | 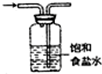 除去氯气中氯化氢 |
| A. | X、Y、Z的浓度不再变化 | |
| B. | 单位时间生成a mol X,同时生成3a mol Y | |
| C. | X、Y、Z的分子数比为1:3:2 | |
| D. | Z生成的速率与X生成的速率相等 |
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | CaO+H2O═Ca(OH)2 |
| A. | X、Y、Z三种元素在周期表中处于同一周期 | |
| B. | 同主族元素中的X的气态氢化物最稳定 | |
| C. | 同一周期元素中Z的最高价氧化物对应的水化物酸性最强 | |
| D. | Y、Z所形成的化合物属于酸性氧化物 |
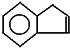 ,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系:
,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系: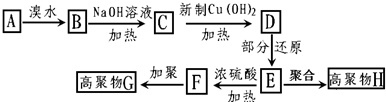
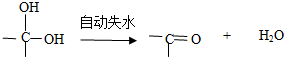
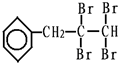 、C的结构简式:
、C的结构简式: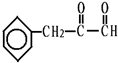
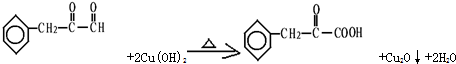

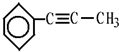
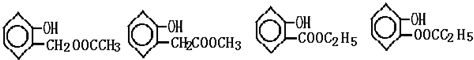 (任写一个)
(任写一个)
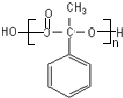 ;
;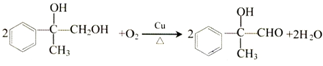 ,
, ;
;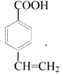 (写结构简式).
(写结构简式). ,Z的化学式SiO2;
,Z的化学式SiO2;