题目内容
9.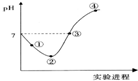 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| B. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) | |
| C. | 实验进程中溶液的pH可以用pH试纸测得 | |
| D. | 曲线起点处水的电离程度最大 |
分析 整个过程发生的反应为Cl2+H2O═HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,
A.HClO为弱电解质,应写成化学式;
B.根据电荷守恒c(H+)+c(Na+)=c(Cl-)+c(Cl0-)+c(OH-)判断;
C.次氯酸具有漂白性,不能用pH试纸测量;
D.当全被生成NaClO时促进水的电离.
解答 解:A.HClO为弱电解质,应写成化学式,离子方程式为Cl2+H2O=H++Cl-+HClO,故A错误;
B.③点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(Cl0-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),故B正确;
C.溶液中含有次氯酸,具有漂白性,不能用pH试纸测量,故C错误;
D.当全被生成NaClO时,可水解,促进水的电离,故D错误.
故选B.
点评 本题综合考查氯气的性质,侧重于学生的分析能力的考查,注意理解溶液中的溶质及其性质是解本题关键,根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),为易错点,难度中等.

练习册系列答案
相关题目
19.乙醇可以发生下列反应,在反应中乙醇分子断裂O-H和C-H键的是( )
| A. | 乙醇与金属钠反应 | |
| B. | 乙醇在铜丝存在条件下发生催化氧化 | |
| C. | 乙醇与乙酸发生的酯化反应 | |
| D. | 乙醇在浓硫酸存在下发生消去反应 |
20.2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的2645Fe原子,有关2645Fe的说法正确的是( )
| A. | 它是一种新元素 | B. | 2645FeFe与2656Fe互为同素异形体 | ||
| C. | 它是一种新原子 | D. | 这种铁原子的中子数是26 |
17.下列叙述中错误的是( )
| A. | 原子半径:Cl>S | B. | 金属性:Na>Mg | ||
| C. | 稳定性:HF>HCl | D. | 酸性:HClO4>H2SO4 |
4.在55℃时,下列说法正确的是( )
| A. | 向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 | |
| B. | pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L | |
| C. | 饱和氯水中:c(Cl-)=c(ClO-)+c(HClO) | |
| D. | 0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
14. 已知NaHSO3溶液在不同温度下均可被过量 KIO3氧化,当 NaHSO3完全消耗即有 I2析出,依据 I2析出所需时间可以求得 NaHSO3的反应速率.将浓度均为 0.020mol•L-1的 NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液 40.0mL 混合,记录 10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
已知NaHSO3溶液在不同温度下均可被过量 KIO3氧化,当 NaHSO3完全消耗即有 I2析出,依据 I2析出所需时间可以求得 NaHSO3的反应速率.将浓度均为 0.020mol•L-1的 NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液 40.0mL 混合,记录 10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
 已知NaHSO3溶液在不同温度下均可被过量 KIO3氧化,当 NaHSO3完全消耗即有 I2析出,依据 I2析出所需时间可以求得 NaHSO3的反应速率.将浓度均为 0.020mol•L-1的 NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液 40.0mL 混合,记录 10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
已知NaHSO3溶液在不同温度下均可被过量 KIO3氧化,当 NaHSO3完全消耗即有 I2析出,依据 I2析出所需时间可以求得 NaHSO3的反应速率.将浓度均为 0.020mol•L-1的 NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液 40.0mL 混合,记录 10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前,溶液变蓝的时间随温度的升高而缩短 | |
| B. | 图中a点对应的 NaHSO3反应速率为 5.0×10-5mol•L-1•s-1 | |
| C. | 图中b、c两点对应的 NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
18.下列说法正确的是( )
| A. | 8g碳和14g氧气反应生成22g二氧化碳 | |
| B. | 二氧化碳由一个碳原子和两个氧原子构成 | |
| C. | 1g硫和1g氧气反应生成2g二氧化硫 | |
| D. | 水银温度计在温度升高时水银柱上升是因为汞原子的体积变大 |
19.已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:A$→_{一定条件}^{+X}$ B$→_{一定条件}^{+X}$ C,下列说法错误的是( )
| A. | 若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”,则X为O2 | |
| B. | 若X是生活中常见的过渡金属,A是黄绿色气体,则B→C的离子方程式为Fe+2Fe3+=3Fe2+ | |
| C. | 若C是一种酸式盐,则X一定是CO2 | |
| D. | A既可以为金属单质,也可以为非金属单质 |
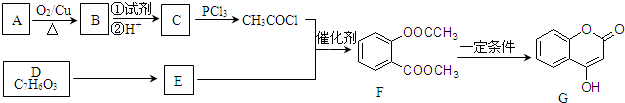
 .
.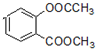 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.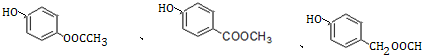 .
.