题目内容
19.乙醇可以发生下列反应,在反应中乙醇分子断裂O-H和C-H键的是( )| A. | 乙醇与金属钠反应 | |
| B. | 乙醇在铜丝存在条件下发生催化氧化 | |
| C. | 乙醇与乙酸发生的酯化反应 | |
| D. | 乙醇在浓硫酸存在下发生消去反应 |
分析 A.乙醇与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键;
B.乙醇催化氧化为乙醛,断开的是第二个碳上的碳氢键和氢氧键;
C.酯化反应是酸脱羟基,醇脱氢,乙醇断裂羟基上的氢氧键;
D.乙醇发生消去反应生成乙烯和水,断开的是第一个甲基上的碳氢键和碳氧键.
解答 解:A.乙醇与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键,故A错误;
B.乙醇在铜丝存在条件下发生催化氧化为乙醛,断开的是第二个碳上的碳氢键和氢氧键,故B正确;
C.乙醇的酯化反应是酸脱羟基,醇脱氢,乙醇断裂羟基上的氢氧键,故C错误;
D.乙醇在浓硫酸存在下发生消去反应生成乙烯和水,断开的是第一个甲基上的C-H键和C-O键,故D错误.
故选B.
点评 本题主要考查了乙醇的化学性质,掌握反应的机理是解题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.如图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是( )
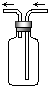

| A. | NO | B. | CO | C. | NH3 | D. | SO2 |
15.下列有关物质结构和性质的叙述正确的是( )
| A. | 若两种粒子的核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子核外电子排布 | |
| C. | 金属元素的原子肯定不可能出现在阴离子中 | |
| D. | 两中性原子的核外电子排布相同,则一定属于同种元素 |
14.下列各选项的两个反应属于同一反应类型的是( )
| 选项 | 反应I | 反应II |
| A | 在光照条件下,异丁烷与溴蒸气反应制取(CH3)3CBr | 将乙烯通入溴的四氯化碳溶液中制取1,2一二溴乙烷 |
| B | 在镍作催化剂的条件下,苯与氢气反应生成环乙烷 | 在催化剂作用下,乙烯与水反应生成乙醇 |
| C | 在银作催化剂的条件下,乙醇与空气中的氧气反应生成乙醛 | 在一定条件下,由氯乙烯(CH2=CHCl)合成聚氯乙烯 |
| D | 乙酸乙酯在酸的催化作用下与水反应生成乙酸和乙醇 | 在一定条件下,液态油脂与氢气反应制造人造脂肪 |
| A. | A | B. | B | C. | C | D. | D |
4.化学来源于生活,并应用于生产生活中.下列关于化学与生产、生活的认识不正确的是( )
| A. | 将煤气化、液化等方法处理,是提高燃料燃烧效率的重要措施之一 | |
| B. | CO2、CxHy、N2等均是造成温室效应的气体 | |
| C. | 乙醇、天然气、液化石油气、氢气都可以作为燃料电池的原料,其中氢气是最为环保的原料 | |
| D. | 合理开发利用可燃冰(固态甲烷水台物)有助于缓解能源紧缺 |
11.在不同温度下,向VL密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(8)=N2(g)+CO2(g)△H=-Qkj•mol-1(Q>0),达到平衡时的数据如下:
下列有关说法正确的是( )
| 温度/℃ | n (C)/mol | n(CO2)/mol |
| T1 | 0.15 | |
| T2 | 0.375 |
| A. | 由上述信息可推知:T1>T2 | |
| B. | T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)增大 | |
| C. | T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大 | |
| D. | T1℃时,该反应的平衡常数$K=\frac{9}{16}$ |
9.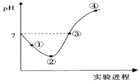 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| B. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) | |
| C. | 实验进程中溶液的pH可以用pH试纸测得 | |
| D. | 曲线起点处水的电离程度最大 |
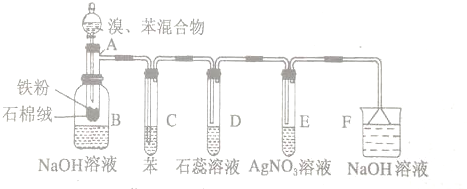
 Ω=2,则有机物
Ω=2,则有机物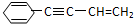 的不饱和度为( )
的不饱和度为( )