题目内容
4.在55℃时,下列说法正确的是( )| A. | 向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 | |
| B. | pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L | |
| C. | 饱和氯水中:c(Cl-)=c(ClO-)+c(HClO) | |
| D. | 0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.加入硫酸氢钠固体后,溶液中氢离子浓度增大,抑制了水的电离;
B.常温下,pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L,不是常温下,不能使用常温下水的离子积计算;
C.根据反应方程式及物料守恒分析;
D.铵根离子水解程度较小,则c(NH4+)>c(SO42-).
解答 解:A.向水中加入少量硫酸氢钠固体,c(H+)增大,由于温度不变,Kw不变,由于溶液中氢离子浓度增大,抑制了水的电离,故A错误;
B.在55℃时,不是常温下,不能使用常温下水的离子积计算,故B错误;
C.饱和氯水中,氯气与水反应生成等浓度的氯化氢和次氯酸,结合物料守恒可得:c(Cl-)=c(HCl)=c(ClO-)+c(HClO),故C正确;
D.0.1mol/L的(NH4)2SO4溶液中,铵根离子部分水解,则溶液显示酸性,由于水解程度较小,则c(NH4+)>c(SO42-),溶液中正确的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确物料守恒、电荷守恒及盐的水解原理的应用为解答关键,C为易错点,需要明确氯气与水的反应中生成氯化氢和次氯酸的量的关系,然后利用物料守恒分析.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
14.下列各选项的两个反应属于同一反应类型的是( )
| 选项 | 反应I | 反应II |
| A | 在光照条件下,异丁烷与溴蒸气反应制取(CH3)3CBr | 将乙烯通入溴的四氯化碳溶液中制取1,2一二溴乙烷 |
| B | 在镍作催化剂的条件下,苯与氢气反应生成环乙烷 | 在催化剂作用下,乙烯与水反应生成乙醇 |
| C | 在银作催化剂的条件下,乙醇与空气中的氧气反应生成乙醛 | 在一定条件下,由氯乙烯(CH2=CHCl)合成聚氯乙烯 |
| D | 乙酸乙酯在酸的催化作用下与水反应生成乙酸和乙醇 | 在一定条件下,液态油脂与氢气反应制造人造脂肪 |
| A. | A | B. | B | C. | C | D. | D |
15.已知Na2SO3在空气中易被氧化为Na2SO4,现有一包包装破损的白色Na2SO3固体粉末,为了检验其是否变质,正确的方法是( )
| A. | 取少量样品于试管中,滴入稀盐酸,无沉淀,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| B. | 取少量样品于试管中,滴入稀硝酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| C. | 取少量样品于试管中,滴入稀硫酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| D. | 取少量样品于试管中,滴入稀盐酸,若产生使品红溶液褪色的气体,则说明已变质 |
12.为纪念编制了第一个元素周期表的俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔.下列关于了258Md和260Md的叙述正确的是( )
| A. | 258Md原子所含中子数与质子数之差为56 | |
| B. | 258Md和260Md互称为同素异形体 | |
| C. | 258Md和260Md为同一种核素 | |
| D. | 有一种Md元素的相对原子质量为258 |
19.下列说法正确的是( )
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池中电子流出的一极是正极,发生氧化反应 | |
| C. | 原电池的两极发生的反应均为氧化还原反应 | |
| D. | 形成原电池后,电子有负极向正极移动 |
9.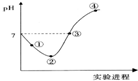 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| B. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) | |
| C. | 实验进程中溶液的pH可以用pH试纸测得 | |
| D. | 曲线起点处水的电离程度最大 |
16.根据中学所学相关知识,下列推断正确的一项是( )
| A. | ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 | |
| B. | 氯气可置换出KBr溶液中的溴,则氟气也可置换出KBr溶液中的溴 | |
| C. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-14+d mol•L-1 | |
| D. | 某温度下,MgCO3的Ksp=6.8×10-6,则该温度下所有含固体MgCO3的溶液,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.8×10-6 |
13.元素X原子最外层上有3个电子,元素Y最外层上有6个电子,由X、Y两种元素形成的化合物的化学式可能为( )
| A. | XY | B. | X2Y3 | C. | XY2 | D. | X2Y |
14.下列金属可用来与稀硫酸反应制备H2的是( )
| A. | Mg | B. | Ag | C. | Cu | D. | Fe |