题目内容
17.下列叙述中错误的是( )| A. | 原子半径:Cl>S | B. | 金属性:Na>Mg | ||
| C. | 稳定性:HF>HCl | D. | 酸性:HClO4>H2SO4 |
分析 A.同一周期内,原子半径随着原子序数增大而减小;
B.同一周期元素,元素金属性随着原子序数增大而减弱;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A.同一周期内,原子半径随着原子序数增大而减小,所以原子半径Cl<S,故A错误;
B.同一周期元素,元素金属性随着原子序数增大而减弱,所以金属性Na>Mg,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl,所以氢化物的稳定性HF>HCl,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S,所以酸性:HClO4>H2SO4,故D正确;
故选A.
点评 本题考查同一周期元素金属性、非金属性、氢化物的稳定性、原子半径等元素周期律,以第三周期为例熟练掌握同一周期元素原子结构及性质递变规律,题目难度不大.

练习册系列答案
相关题目
5.下列说法中正确的是( )
①${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质
②元素周期表中元素排列顺序的依据是元素的相对原子质量
③原子的种类大于元素的种类
④所有的原子都含有质子、中子、电子
⑤质子数相同的微粒一定是同种元素
⑥质子数相同、电子数也相同的两种微粒,不可能一种是分子,另一种是离子
⑦同种元素的原子只能有一种质量数
⑧两原子如果核外电子排布相同,则一定属于同种元素
⑨第四、五、六周期称为长周期
⑩过渡元素包括了大部分金属元素.
①${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质
②元素周期表中元素排列顺序的依据是元素的相对原子质量
③原子的种类大于元素的种类
④所有的原子都含有质子、中子、电子
⑤质子数相同的微粒一定是同种元素
⑥质子数相同、电子数也相同的两种微粒,不可能一种是分子,另一种是离子
⑦同种元素的原子只能有一种质量数
⑧两原子如果核外电子排布相同,则一定属于同种元素
⑨第四、五、六周期称为长周期
⑩过渡元素包括了大部分金属元素.
| A. | ①②③⑥⑧ | B. | ③⑥⑧⑨⑩ | C. | ②③⑤⑥⑦ | D. | ④⑤⑥⑨⑩ |
12.为纪念编制了第一个元素周期表的俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔.下列关于了258Md和260Md的叙述正确的是( )
| A. | 258Md原子所含中子数与质子数之差为56 | |
| B. | 258Md和260Md互称为同素异形体 | |
| C. | 258Md和260Md为同一种核素 | |
| D. | 有一种Md元素的相对原子质量为258 |
2.在一个不传热的固定容积的密闭容器中,可逆反应N2+3H2?2NH3达到平衡的标志是( )
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3molH-H键断裂,同时2molN-H键断裂 | |
| C. | n(N2):n(H2):(NH3)=1:3:2 | |
| D. | 反应混合物的压强不再改变 |
9.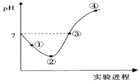 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| B. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) | |
| C. | 实验进程中溶液的pH可以用pH试纸测得 | |
| D. | 曲线起点处水的电离程度最大 |
6.金秋十月,人们只要靠近盛开桂花的桂花树时,就能闻到怡人的桂花香.其原因是( )
| A. | 微粒体积很小 | B. | 微粒之间有间隔 | ||
| C. | 微粒质量很小 | D. | 微粒在不停的运动 |
7.乙烯产量是衡量一个国家石油化工发展水平的标志.下列关于乙烯说法正确的是( )
| A. | 与乙烷互为同分异构体 | B. | 分子中存在C≡C | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 分子中存在C=O |
 Ω=2,则有机物
Ω=2,则有机物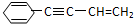 的不饱和度为( )
的不饱和度为( )