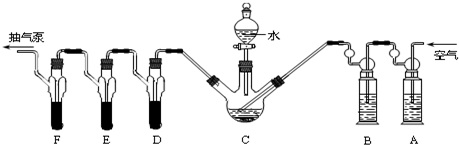
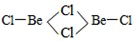
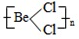题目内容
15.已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | Cl2既是氧化产物又是还原产物 | |
| D. | 0.1mol KClO3 参加反应时有1mol电子转移 |
分析 5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O中,Cl元素的化合价由-1价升高为0,Cl元素的化合价由+5价降低为0,该反应转移5e-,以此解答.
解答 解:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素由-1价升高到0,KClO3中Cl元素由+5价降低为0,
A.含元素化合价降低的物质为氧化剂,则KClO3是氧化剂,故A正确;
B.KCl为还原剂,被氧化,KClO3是氧化剂被还原,由反应可知被氧化与被还原的氯元素的质量比为5:1,故B正确;
C.反应中只有C元素化合价发生变化,则 Cl2既是氧化产物又是还原产物,故C正确;
D.1molKClO3参加反应时有1mol×(5-0)=5mol电子转移,故D错误;
故选D.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

练习册系列答案
相关题目
6.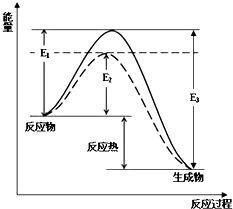 (1)工业合成氨是一个可逆反应:N2(g)+H2(g)?2NH3(g).图中虚线部分是通过改变化学反应中的条件,请解释原因:下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).
(1)工业合成氨是一个可逆反应:N2(g)+H2(g)?2NH3(g).图中虚线部分是通过改变化学反应中的条件,请解释原因:下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).
(2)Mg2Cu是一种储氢合金.350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077).Mg2Cu与H2反应的化学方程式为2Mg2Cu+3H2$\frac{\underline{\;\;△\;\;}}{\;}$MgCu2+3MgH2.
(3)锡常见的价态有+2和+4价,在化合物中稳定的价态为+4价,则配制的SnCl2的水溶液除了固体SnCl2和水外,还需要的物质是盐酸和Sn.
(4)汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据:不能实现,因为其△H-T△S>0.
(5)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料.
已知:a、25℃时,KSP[Mg(OH)2]=4.0×10-38;b、Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ•mol-1.
①下列叙述正确的是BD.
A、从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂是它分解吸热且生成MgO覆盖可燃物
C、可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
D、高温下,碳可以和氧化镁发生反应
②酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为蓝色.
 (1)工业合成氨是一个可逆反应:N2(g)+H2(g)?2NH3(g).图中虚线部分是通过改变化学反应中的条件,请解释原因:下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”).
(1)工业合成氨是一个可逆反应:N2(g)+H2(g)?2NH3(g).图中虚线部分是通过改变化学反应中的条件,请解释原因:下表为不同温度下该反应的平衡常数.由此可推知,表中T1<573K(填“>”、“<”或“=”). | T/K | T1 | 573 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
(3)锡常见的价态有+2和+4价,在化合物中稳定的价态为+4价,则配制的SnCl2的水溶液除了固体SnCl2和水外,还需要的物质是盐酸和Sn.
(4)汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据:不能实现,因为其△H-T△S>0.
(5)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料.
已知:a、25℃时,KSP[Mg(OH)2]=4.0×10-38;b、Mg(OH)2(s)=MgO(s)+H2O(g)△H=+81.5kJ•mol-1.
①下列叙述正确的是BD.
A、从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂是它分解吸热且生成MgO覆盖可燃物
C、可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
D、高温下,碳可以和氧化镁发生反应
②酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
3.下列说法正确的是( )
| A. | 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积,其比值一定为2:1 | |
| B. | 将NaOH溶液和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的二分之一 | |
| C. | 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍 | |
| D. | 制取TiO2可用TiCl4加大量水,同时加热:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl,所得的TiO2•H2O经焙烧得TiO2 |
20.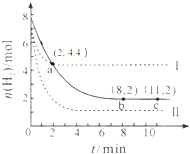 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 曲线Ⅰ对应的条件改变可能降低温度 | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 该温度下,此反应的化学平衡常数的数值为0.5 | |
| D. | 从反应开始至a 点,ν(CO2)=0.6 mol•L-1•min-1 |
7.有关物质的分类,下列说法正确的是( )
| A. | CH3CH(CH3)2属于链状化合物 | B. | 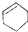 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 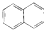 属于脂环化合物 属于脂环化合物 | D. | 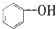 属于芳香烃 属于芳香烃 |
4.反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2.
下列说法正确的是( )
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2.
下列说法正确的是( )
| A. | 两个反应中均为硫元素被氧化 | |
| B. | 反应①、②中生成等量的I2时转移电子数比为1:5 | |
| C. | 氧化性:MnO2>SO42->IO3->I2 | |
| D. | 碘元素在反应①中被还原,在反应②中被氧化 |